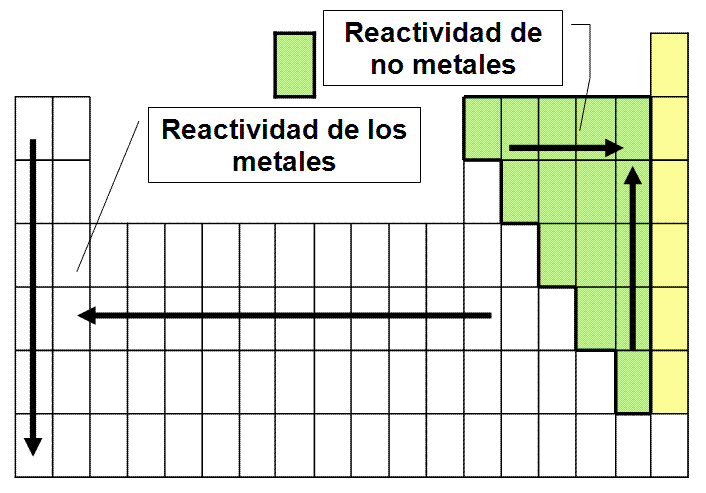
LA reactividad química de los metales varía con su electropositividad, por lo que cuanto más electropositivo es el elemento, más reactivo es el metal. Los metales más reactivos son los que tienen una gran tendencia a perder electrones, por lo que forman iones positivos con mayor facilidad.
Por ejemplo: colocando una hoja de hierro en una solución de sulfato de cobre (II), se verifica que la hoja de hierro está cubierta por una capa de metal rojo (cobre). Por otro lado, la solución se vuelve amarilla (solución de sulfato de hierro II).
Por lo tanto, de acuerdo con la siguiente ecuación, se produce la reacción de desplazamiento entre el elemento químico hierro (Fe) y sulfato de cobre (CuSO).4), formando sulfato ferroso (FeSO4) y el cobre metálico (Cu).
Fe(s) + CuSO4 (aq) → FeSO4 (aq) + Cu(s)
La ocurrencia de esta reacción nos hace concluir que el metal de hierro es más reactivo que el metal de cobre, ya que el hierro es capaz de desplazar al cobre de su compuesto inicial.
Mediante reacciones de este tipo, los metales se pueden clasificar por su reactividad química, como se muestra a continuación, con los metales más reactivos a la izquierda y los menos reactivos a la derecha. Se destaca el elemento hidrógeno, a pesar de no ser metálico, ya que muchas publicaciones lo consideran como un estándar, al que se relacionan otros elementos en su reactividad química.
(+)Li> Cs> Rb> K> Ba> Sr> Ca> Na> Mg> Be> Al> Zn> Cr> Fe> Cd> Co> Ni> Pb> H> Sb> Bi> Cu> Hg> Ag> Pd> Pt> Au (-)
Esta secuencia debe leerse como: el litio (Li) es más reactivo que el cesio (Cs), que es más reactivo que el rubidio (Rb), y así sucesivamente.
La reactividad química de los no metales varía con la electronegatividad; por lo tanto, cuanto más electronegativo es el elemento, más reactivo es el no metal. Los no metales más reactivos son aquellos que tienen una gran tendencia a recibir electrones, por lo que forman iones negativos con mayor facilidad.
Por ejemplo, gas flúor (Fdos), a través de una reacción de desplazamiento, reacciona químicamente con el ácido clorhídrico (HCl), formando ácido fluorhídrico (HF) y cloro gaseoso (Cldos) porque el flúor no metálico es más reactivo que el cloro no metálico. Esta ecuación se puede ver a continuación.
F2 (g) + 2HCl(gramo) → 2HF(gramo) + Cl2 (g)
Los no metales, mediante reacciones de desplazamiento de este tipo, también se pueden organizar según su reactividad, como se muestra en la secuencia a continuación, que sigue el mismo patrón que el anterior.
(+)F> O> N> Cl> Br> I> S> C> P (-)
Esta nueva secuencia debería leerse como: el flúor (F) es más reactivo que el oxígeno (O), que es más reactivo que el nitrógeno (N), y así sucesivamente.
Referencias:
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; La química en el enfoque de la vida cotidiana, Ed. Moderna, vol.1, São Paulo / SP-1998.
http://www.dqi.iq.ufrj.br/iqg128_a8_reativ_metais.pdf