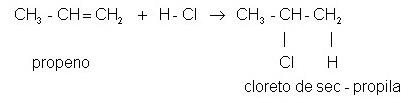
Dejemos que la reacción de halogenación del propeno sea dada por el siguiente esquema:
Como puede verse, el compuesto formado (cloruro de sec-propilo) se satura (disminuye, o en este caso, cancela una insaturación entre átomos de carbono al incluir algún ligando) mediante la unión sistemática de un átomo de cloro al carbono secundario y uno de hidrógeno a la izquierda.
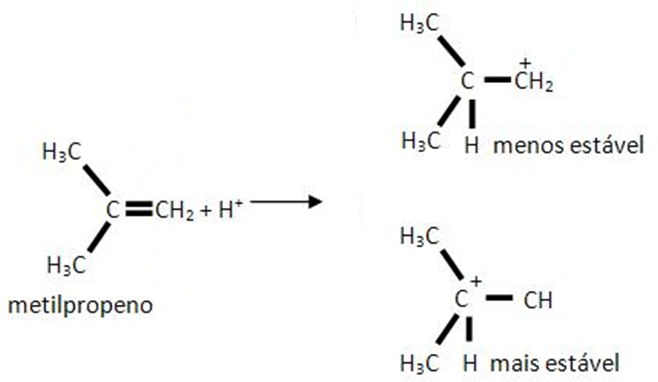
De hecho, es posible la aparición de compuestos paralelos, como se muestra en el esquema de reacción del metilpropeno con iones de hidrógeno:
Desde un punto de vista estructural, ambos productos de la reacción son inestables, a menos que este hidrógeno esté asociado con algún ligando (halógeno, como cloro o yodo). Sin embargo, analizando los enlaces establecidos, la segunda forma es más estable que la primera precisamente porque existe una compensación de la carga positiva adquirida por el carbono con la tendencia a repeler los electrones que tienen los grupos alquilo (característica nucleofílica). Por tanto, el ion carbónico se encuentra en una posición más favorable.
Al observar los dos ejemplos, queda clara la regla de Markovnikov para la eliminación de enlaces insaturados (mediante reacciones de adición) o la descaracterización de ligandos en los enlaces saturados (mediante sustitución): En una reacción de adición del tipo alqueno o alquino + HX (donde X es un halógeno), el hidrógeno se une al carbono más hidrogenado de la insaturación, mientras que el halógeno se une al carbono menos hidrogenado.. También se puede ampliar a: en una reacción de sustitución, el halógeno se une al carbono con el mayor número de enlaces saturados. Vea la ilustración a continuación:

CH3-Br -> CH3+ + Br– ΔH = 915Kj
CH3-CHdos– Br -> CH3-CHdos+ + Br– ΔH = 700Kj
Así, se puede ver que la energía necesaria para establecer un enlace entre halógeno y carbono crece con la disminución del número de enlaces saturados que tiene. Por tanto, la preferencia por los carbonos cuaternarios, terciarios, secundarios y primarios (necesariamente en ese orden – para la sustitución) o con un mayor número de enlaces (teniendo en cuenta los enlaces carbono-carbono insaturados y los que implican otros radicales, como el hidrógeno – para la adición).
Referencias:
http://www.colegioweb.com.br/quimica/explicacao-da-regra-de-markovnikov.html