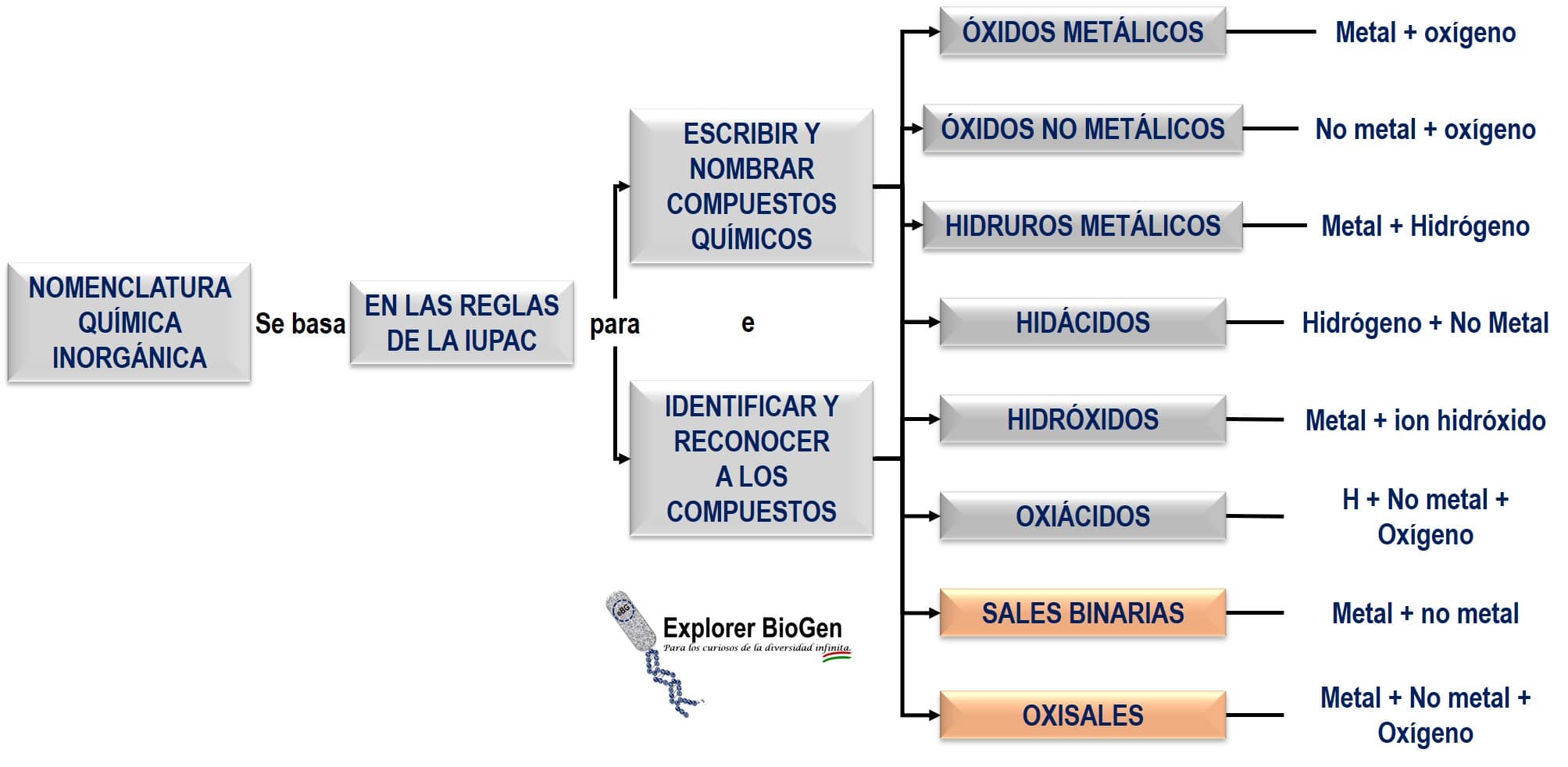
sales inorgánicas son compuestos químicos formados por el enlace iónico de cationes (formado por un metal o por el ion amonio (NH4+)) y aniones. La fórmula molecular se puede representar genéricamente por XY, donde X representa el catión e Y el anión. En medios acuosos las sales se disocian liberando cationes y aniones:
XY + HdosO → X+ + Y–
Las sales se obtienen de la reacción química entre un ácido (orgánico o inorgánico) y una base. Esta reacción se llama neutralización y, además de la sal, se forma agua.
Ácido + Base → Sal + Agua
CH3–COOH + NaOH → CH3–COONa + HdosO
HCl + NaOH → NaCl + HdosO
Estos compuestos son sólidos a temperatura ambiente y tienen altos puntos de fusión y ebullición. En general, son solubles en agua y cuando se disuelven son excelentes conductores. Sin embargo, también existen sales insolubles.
Por su comportamiento en reacciones químicas, se pueden clasificar en sales neutras, ácidas, básicas, mixtas e hidratadas. A continuación, aprenderemos las características de cada uno de estos tipos de sales.
Clasificación de sales inorgánicas
sal neutra: se forma a partir de una reacción de neutralización total, es decir, todos los iones H3O+ son neutralizados por hidroxilos (OH–) presente en la solución. Ocurren entre un ácido fuerte y una base fuerte y la solución acuosa de la sal formada tiene un pH neutro.
2HF + Ca (OH)dos → CaFdos + 2HdosO
Otros ejemplos: caso4, NH4CO3 , KBr, NaCl, KCN, CudosSOLO4, AdosCO3.
sal ácida: se forma a partir de una reacción de neutralización parcial, donde no todos los iones H3O+ son neutralizados por hidroxilos (OH–) presente en la solución. Ocurren entre un ácido fuerte y una base débil y la solución acuosa de la sal formada tiene un pH de menos de 7. También se conocen como sal hidrogenada o sal de hidrógeno.
HCl + NH4OH → NH4Cl + HdosO
Otros ejemplos: NaHSO4, NaHCO3 , CaHBO3
sal básica: se forma a partir de una reacción de neutralización parcial, donde no todos los iones OH- son neutralizados por el H3O + presente en la solución. Ocurren entre un ácido débil y una base fuerte y la solución acuosa de la sal formada tiene un pH superior a 7. También se conocen como sal hidroxilada.
CH3-COOH + NaOH → CH3COONa + HdosO
Otros ejemplos: MgOHCl, Al (OH)dosClO3, Al (OH) Cldos, Ca (OH) F
sal mixta: Consta de 2 cationes (excepto el H+) y un anión, o un catión y dos aniones (excepto OH–).
Ejemplos: Tipo4CN, AgFeBO3, Tipo4C, NaKSO4.
sal hidratada: tiene moléculas de agua incrustadas en su retículo cristalino.
Ejemplos: CaCldos.2HdosOh, CuSO4.6HdosOh, CuSO4.5hdosO
Un tipo específico de sal hidratada es la sal de alumbre, que está formada por dos aniones sulfato, con cationes que tienen un número de oxidación de +1 y +3, además de 24 moléculas de agua.
Ejemplos: AgdosSOLO4.Alabamados(SOLO4)3.24Hdosen undosSOLO4.Sbdos(SOLO4)3.24HdosO
Nomenclatura de sales inorgánicas
En cuanto a la nomenclatura de las sales, la regla general es muy sencilla, sin embargo es necesario conocer los nombres de los cationes y aniones, o consultar una tabla:
nombre del anión + de + nombre del catión
Esta regla se puede seguir estrictamente para compuestos que contienen metales con NOX fijo, como plata, zinc o un elemento perteneciente a las familias 1A, 2A y 3A.
Veamos algunos ejemplos:
- NaNO3: aquí tenemos el catión sodio (Na+) y el anión nitrato (NO3–), por lo que el nombre de la sal es nitrato de sodio.
- K3POLVO4 : aquí tenemos el catión potasio (K+1) y el anión fosfato (PO4-3) por tanto, el nombre de la sal es fosfato de potasio.
Hay casos en los que el catión tiene nox variable, por lo que debe dejar esto claro en el nombre. Veamos el caso del elemento químico hierro, tiene estados de oxidación de +2 a +6, siendo los más comunes +2 y +3, por lo que al nombrar el elemento es necesario informar a qué sal de hierro se refiere:
- Fe2 (TAN4)3: En esta sal, el hierro nox es +3 y el anión es el sulfato, por lo que el nombre es sulfato de hierro III.
- FeSO4: En este compuesto, el hierro nox es +2 y el anión es sulfato, por lo que el nombre es sulfato de hierro II.
Esta diferenciación en el nombre es importante, porque si llamáramos a la sal sulfato de hierro, sería incorrecta. Un consejo para conocer el estado de oxidación del hierro es observar el subíndice junto a los parientes donde está el anión, en el primer caso el subíndice es 3, por lo que el hierro nox es 3. Otra forma de encontrar el nox es sumar la carga de aniones y cationes, que deben dar cero, ya que la sal es neutra. Por ejemplo para el compuesto FeSO4, buscando una tabla de aniones, veremos que el sulfato tiene una carga 2 (SO4dos-). Entonces llama a la carga en Fe x, agrégala a la carga en el anión y es igual a cero:
x + (- 2) = 0
x – 2 = 0
x = 2
Aún en relación a la nomenclatura, hay algunos detalles para observar los casos a continuación, y para eso veremos algunos ejemplos.
Sales de hidrógeno: antes del nombre del anión, es necesario poner el prefijo que hace referencia a la cantidad de hidrógeno presente.
- NaHCO3: monohidrógeno carbonato de sodio.
Sal de hidroxilo: antes del nombre del anión, es necesario poner el prefijo referente a la cantidad de hidroxilo presente, seguido del prefijo hidroxi.
- Al (OH)dosClO3: dihidroxi clorato de aluminio
Incluso tienes la opción de incluir el prefijo monobásico entre el nombre del catión y el anión.
- Ca (OH) F: fluoruro de calcio monobásico
- Al (OH) Cldos : cloruro de aluminio monobásico
Sal hidratada: después del nombre del catión, es necesario indicar la cantidad de moléculas de agua presentes.
- CaCldos . 2hdosO: cloruro de calcio dihidratado.
Sal doble: tenemos 2 casos posibles, sales con 2 cationes y 1 anión o 2 aniones y 1 catión. En el caso de 2 cationes, debe escribir la palabra doble después del anión. El orden descrito en el nombre de los cationes comienza con el más electropositivo.
- AgFeBO3: borato (doble) de plata y hierro II.
En el caso de 2 aniones, siga la secuencia:
nombre del anión más electronegativo + nombre del anión menos electronegativo + de + nombre del catión
- Tipo4CN: fosfato de cianuro de titanio IV.
Las sales también se pueden clasificar en términos del número de diferentes elementos presentes en su fórmula molecular. Podemos tener sales binarias (NaCl, KI), ternarias (KNO)dos, Aldos(SOLO4)3), cuaternario (NaHCO3, AdosHPO4) etcétera. Es de destacar que no se evalúa el número total de elementos químicos, sino el número de elementos químicos diferentes. Entonces, aunque la sal CuSO4 tiene un total de 1 Cu + 1S + 4O, es ternario, ya que cada elemento se cuenta solo una vez.
Una propiedad importante de las sales es su solubilidad, que variará según los aniones y cationes que las componen. A continuación se muestra una tabla que resume las solubilidades de las sales:
| solubilidad en agua | |||
| Soluble (regla) | Insolubles (excepción) | Insoluble (regla) |
Soluble (excepción) |
| Nitratos (NO3–)
Acetatos (CH3-ARRULLO–) |
————— | Sulfuros (Sdos-) | Grupos 1,2 y NH4+ |
| Cloruros (Cl–)
Bromuros (Br–) Yoduros (yo–) |
Ag+, Pb2+, hgdos2+ | Carbonatos (CO3dos-) | Grupo 1 y NH4+ |
| Sulfatos (SO4dos-) | Aquí2+, señor2+ Licenciado en Letras2+, Pb2+ | Fosfatos (PO43-) | Grupo 1 y NH4+ |
Entre las sales más importantes y sus aplicaciones podemos mencionar las que se describen a continuación:
| sal | aplicaciones |
| Cloruro de sodio (NaCl) | sal de mesa
Suero fisiológico suero casero Producción de cloro gaseoso (Cldos) e hipoclorito de sodio (NaClO): 2 NaCl + 2 HdosO → 2 NaOH + Hdos + Cldos |
| Carbonato de sodio (NadosCO3) | Producción de vidrio
Producción de tintes tratamiento de piscina Producción de jabón y detergente, papel celulósico, industria textil y siderúrgica. |
| Bicarbonato de sodio (NaHCO3) | Antiácidos
levadura de pastel Extintor de incendios pastas de dientes |
| Carbonato de calcio (CaCO3) | producción de vidrio
cementos |
| Nitrato de sodio (NaNO3) | Fertilizantes
Pólvora carne enlatada |
| Fluoruro de sodio (NaF) | pastas de dientes |
| Fosfato de calcio (Ca3(POLVO4)dos) | Fabricación de fertilizantes fosfatados |
| Hipoclorito de sodio (NaClO) | Bactericida
Lejía |
| Nitrato de amonio (NH4EN EL3) | Explosivos |
Referencias:
Atkins, PW; Jones, Loretta. Principios de la química: cuestionando la vida moderna y el medio ambiente, volumen único. 3. ed. Porto Alegre: Bookman, 2006.
Kotz, JC Química general y reacciones químicas. Volumen 1, 9a edición, Cengage Learning, 2015.
Titus y Canto. Química en el enfoque cotidiano. Volumen único, parte A – Química general e inorgánica. Editorial Saraiva 2005.