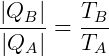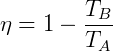La Primera Ley de la Termodinámica aborda la conservación de la energía en los sistemas termodinámicos y su característica cuantitativa, a través de la ecuación que relaciona el calor, el trabajo y la energía interna. La Segunda Ley, de manera más específica y cualitativa, estudia la transformación del calor en trabajo, abordada en la Primera Ley.
Las máquinas térmicas fueron el gran aliciente para que los estudios y, en consecuencia, las leyes de la termodinámica evolucionen. El gran desafío fue crear máquinas cada vez más eficientes. maquina termica es el dispositivo que opera en ciclos, transformando parte de la energía térmica (calor) en energía mecánica (trabajo), rechazando el resto de la energía térmica adquirida.
El francés Nicolas Léonard Sadi Carnot (1796-1832) desarrolló conceptos que fundaron la Segunda Ley, y en el momento en que vivió la Primera Ley, ni siquiera se conocía. Aun así, él fue quien estableció el máximo estándar de eficiencia en una máquina térmica. Hay dos conclusiones importantes de los estudios de Carnot:
- la eficiencia de una máquina (cuya fuente es el calor) depende de la naturaleza del proceso cíclico en el que opera, y no del material que sufre la transformación (sustancia de trabajo);
- no hay máquina más eficiente que la de Carnot, ya que descubrió el proceso cíclico más eficiente para convertir el calor en otras formas de energía.
Además de Carnot, Rudolf Clausius (1822-1888), Lord Kelvin (1824-1907) y Max Planck (1858-1947) contribuyeron a la formulación de la Segunda Ley. Así, tenemos a continuación los dos enunciados que definen el Segunda ley de la termodinámica:
- Declaración de Clausius: el flujo de calor ocurre espontáneamente desde el cuerpo con la temperatura más alta a la temperatura más baja. Lo contrario sería una transformación forzada, que dependería del suministro de energía al sistema para que ocurriera.
- Declaración de Kelvin-Planck: ninguna máquina térmica, que trabaja en ciclos, puede transformar toda la energía térmica recibida (calor) en energía mecánica (trabajo), es decir, no existe una máquina térmica con una eficiencia del 100%.
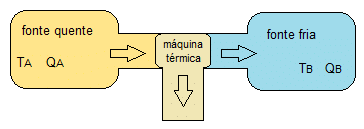
Una conclusión importante, que relaciona estas dos afirmaciones, es que siempre debe haber energía térmica siendo rechazada hacia la fuente fría (cuerpo con menor temperatura). Si la fuente fría no existiera para recibir esta energía, no sería posible generar energía térmica desde la fuente caliente (cuerpo con mayor temperatura). La siguiente figura muestra cómo este proceso es fundamental para el funcionamiento de la máquina térmica.
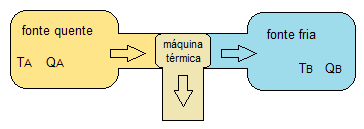
Figura 1. Representación de una máquina térmica (Ta> Tb)
Si la máquina térmica de la figura 1 funciona de acuerdo con Ciclo de Carnot (dos isotermas y dos adiabáticas), por lo que es un Máquina de Carnot y se puede establecer la siguiente relación:
es decir, el módulo de la cantidad de calor en B por el módulo de la cantidad de calor en A es igual a la relación entre las temperaturas de B y A.
ya el Producir de la máquina de Carnot viene dada por:
Para η = 1, el rendimiento sería del 100%, pero para que eso suceda, la temperatura de la fuente fría TB tendría que ser nulo, alcanzando el cero absoluto. Como es imposible alcanzar el cero absoluto, también es imposible tener una máquina térmica con pleno uso.