Para la separación de los componentes de una mezcla, es decir, para la obtención individual de cada una de sus sustancias puras que dieron origen a la mezcla, se utiliza un conjunto de procesos físicos denominados fraccionamiento de mezclas. Estos procesos no modifican la composición de las sustancias que forman una determinada mezcla, ya que toda mezcla es un fenómeno físico, independientemente de que la mezcla tenga un carácter homogéneo o heterogéneo. La elección de los mejores métodos para separar mezclas requiere un conocimiento previo de algunas de las propiedades de las sustancias inicialmente presentes. Entonces, por ejemplo, si tenemos una mezcla de azúcar y arena, debemos tener en cuenta que el azúcar se disuelve en agua, mientras que la arena no se disuelve.
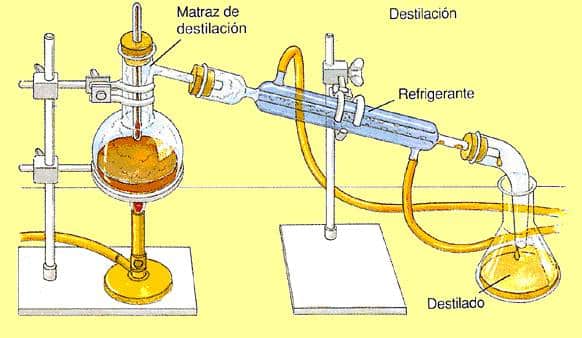
La mezcla de dos o más líquidos (miscibles entre sí) se suele separar mediante destilación fraccionada, proceso que se basa en las diferencias entre los puntos de ebullición de estos líquidos. Sin embargo, existen casos de mezclas homogéneas de líquidos que no pueden separarse mediante procesos físicos, como la destilación. Esto se debe a que dichas mezclas destilan en proporciones fijas y constantes, de modo que sus componentes mantienen esta proporción, como si la mezcla fuera una sustancia pura. Estas mezclas se denominan mezclas azeotrópicas.
Por ejemplo, el alcohol etílico forma una mezcla azeotrópica con agua (95,5% de alcohol y 4,5% de agua) que hierve a una temperatura de 78,1 ° C y mantiene esta proporción también cuando se evapora. Por tanto, el proceso de destilación no es capaz de separar tal mezcla, que ahora se conoce como mezcla azeotrópica.
Entonces, para obtener alcohol anhídrido o alcohol absoluto (alcohol puro) usamos procesos quimicos. Agregue a la mezcla azeotrópica de agua y alcohol, por ejemplo, óxido de calcio (CaO), que reacciona con el agua para producir hidróxido de calcio Ca (OH)dos. Luego, la mezcla se somete a una destilación, ya que ahora solo se destila el alcohol, recogiéndose así puro en otro sistema.
La siguiente tabla muestra algunos casos de mezclas azeotrópicas, con los respectivos porcentajes de sus componentes.
| MEZCLA AZEOTRÓPICA | PUNTO DE EBULLICIÓN |
| alcohol etílico (95,5%) + agua (4,5%) | 78,1 ° C |
| acetona (86,5%) + metanol (13,5%) | 56 ° C |
| alcohol etílico (7%) + cloroformo (93%) | 60 ° C |
| ácido fórmico (77,5%) + agua (22,5%) | 107,3 ° C |
El valor del punto de ebullición que se muestra en la tabla anterior es el de la mezcla. La separación de cada una de las mezclas presentadas se puede realizar, pero son necesarios procedimientos químicos específicos, similares a los discutidos para la separación de etanol del agua.
Referencias:
SARDELLA, Antonio; MATTHEW, Edegar; Curso de Química: química general, Ed. Ática, São Paulo / SP – 1995.