Tabla de contenidos
Si analizamos el número atómico (Z), el número de neutrones (N) y el número de masa (A) de diferentes átomos, será posible identificar y formar conjuntos de átomos con algunas similitudes. Esta propiedad de los átomos se llama similitud atómica.
isótopos
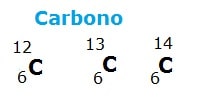
Los isótopos son un conjunto de átomos con el mismo número de protones (Z) pero diferentes números de masa.
El número de masa está formado por el número de protones (número atómico) sumados al número de neutrones en un átomo. Por tanto, se puede concluir que los isótopos son átomos del mismo elemento químico (ya que tienen el mismo número de protones), sin embargo, con diferente número de neutrones. Por ejemplo:
El hidrógeno es el único elemento químico cuyos isótopos tienen un nombre propio. Los otros isótopos se denominan solo por el nombre del elemento seguido del número de masa, como carbono-14, oxígeno-16, etc.
Los isótopos son muy comunes en la naturaleza, pero también pueden obtenerse artificialmente. En el grupo de los isótopos artificiales, merecen destacarse los radiactivos, que son los que emiten determinados tipos de radiación. El flúor-18, por ejemplo, es un radioisótopo ampliamente utilizado en Medicina para el mapeo óseo, el fósforo-32 se aplica a la agricultura para estudiar el metabolismo de los vegetales, el carbono-14 se utiliza en Paleontología para fechar fósiles.
Isobaras
Las isobaras son átomos que tienen diferentes números atómicos pero el mismo número de masa. Como el número de protones no es el mismo, se puede concluir que las isobaras también pertenecen a diferentes elementos químicos.
El carbono-14 y el nitrógeno son ejemplos de isobaras, ya que ambos tienen un número de masa (A) = 14.
Isotonos
Los átomos que tienen el mismo número de neutros, pero diferentes números atómicos y de masa, se denominan isotonos. La isotonía también ocurre entre átomos de diferentes elementos químicos. Como ejemplos de isotonas podemos mencionar el boro (B) y el berilio (Be), que tienen 6 neutrones en sus átomos. Mirar: 
isoelectrónica
Los átomos neutros tienen la misma cantidad de protones y electrones, sin embargo, estos átomos pueden ganar o perder electrones, comenzando a formar iones. Los átomos e iones que tienen el mismo número de electrones se denominan isoelectrónica. Ejemplos:
Referencia:
http://www.estudopratico.com.br/isotopos-isobaros-e-isotonos-classificacao-dos-atomos/