Tabla de contenidos
La solidificación es el cambio de estado líquido a sólido. Para que se produzca la solidificación, es necesario que, bajo una determinada presión, el cuerpo pierda calor hasta alcanzar una determinada temperatura.
La cantidad de calor necesaria para que un cuerpo se solidifique depende de la sustancia que lo compone.
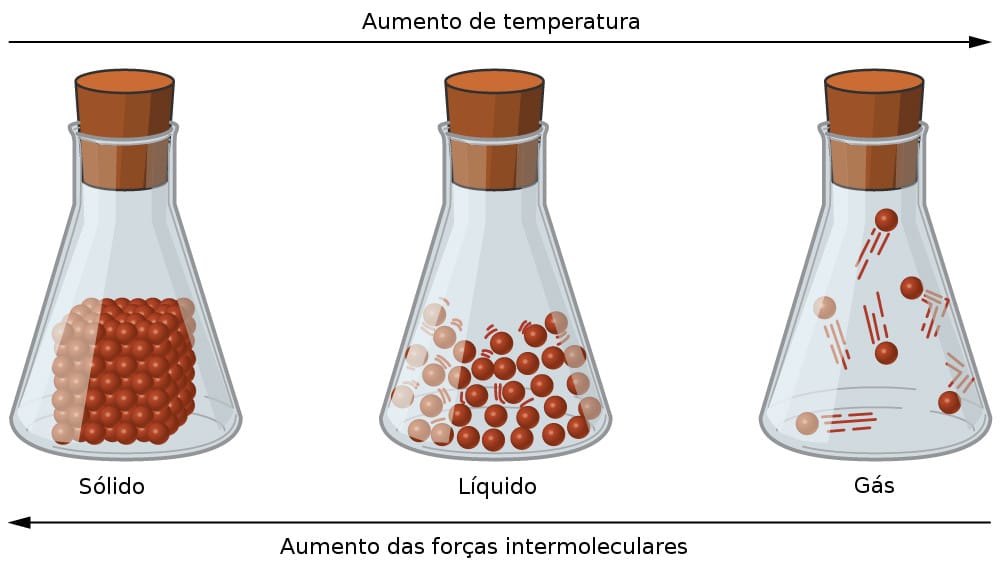
En estado líquido, los átomos de las sustancias están más separados. Tienen un mayor grado de vibración y temperatura que en estado sólido.
Al ceder calor, se produce una reducción de la vibración de los átomos y la distancia entre ellos se acorta. Esta reducción provoca un aumento de las fuerzas internas.
Si continúa perdiendo calor y su temperatura alcanza un cierto valor llamado punto de solidificación, el cuerpo se solidificará.
En estado sólido, la sustancia presenta una mayor organización entre sus átomos, estructurada en una red cristalina. Continúan mostrando movimiento de vibración, sin embargo, esto ocurre alrededor de un punto medio.

Características de solidificación
Los cambios de estado se producen siguiendo un patrón determinado. Se verifica experimentalmente que el proceso de solidificación tiene las siguientes características:
- Manteniendo la presión constante, la temperatura durante todo el proceso de solidificación permanece constante.
- La cantidad de calor por unidad de masa se denomina calor latente de solidificación y es una característica de la sustancia.
- La temperatura a la que cada sustancia se solidifica está bien determinada y se denomina punto de solidificación.
Punto de solidificación
El punto de solidificación es la temperatura a la que debe alcanzar la sustancia para iniciar el proceso de solidificación. Esta temperatura es la misma para que la sustancia se derrita (punto de fusión).
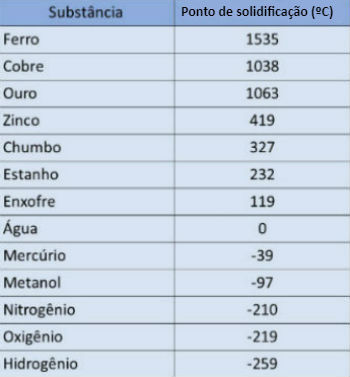
Los puntos de solidificación de las sustancias se determinan experimentalmente. Esta temperatura depende del valor de la presión a la que se somete.
En la siguiente tabla, presentamos el punto de solidificación de algunas sustancias bajo presión desde 1 atmósfera:
Cantidad de calor latente
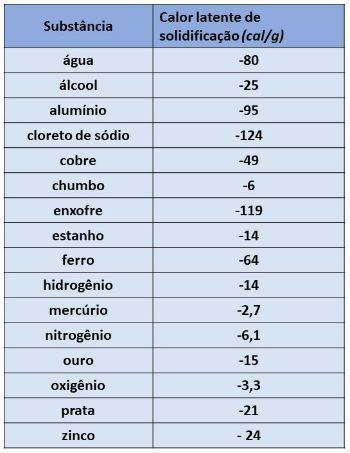
Conociendo la masa de un cuerpo, podemos calcular la cantidad de calor que será necesario perder para que el cuerpo se solidifique. Para ello, debemos conocer el valor del calor latente de solidificación de la sustancia que lo compone.
A continuación, presentamos el valor del calor latente de solidificación de algunas sustancias:
Fórmula
Para calcular la cantidad de calor necesaria para que un cuerpo cambie de fase, utilizamos la siguiente fórmula:
Ser,
Q: cantidad de calor latente (cal)
m: masa (g)
Ls: calor latente de solidificación (cal / g)
Ejemplo
Calcule la cantidad de calor que deben perder 300 g de agua a 0 ºC para convertirse totalmente en hielo a 0 ºC.
El valor del calor latente de solidificación del agua es igual a – 80 cal / g. Sustituyendo en la fórmula, tenemos:
Q = 300. (- 80) = – 24.000 cal.
El signo menos indica que el agua debe perder 24.000 cal para convertirse en hielo.
Anomalía del agua
Las sustancias, en general, disminuyen su volumen cuando solidifican. El agua es una excepción, es decir, cuando se convierte en hielo aumenta de volumen.
Este hecho se puede comprobar cuando ponemos una botella llena de agua en el congelador. Al congelarse, el agua se hinchará y romperá la botella.
Obtenga más información sobre el tema leyendo: Ciclo del agua y estados físicos del agua.
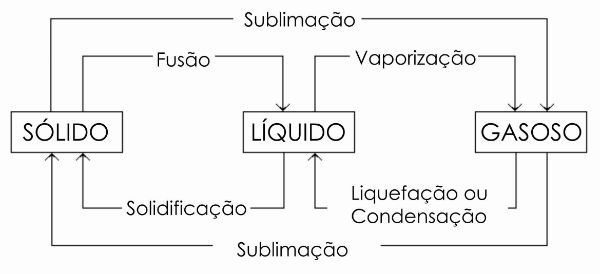
Cambios de fase
Además de la solidificación, existen otros procesos de cambio de estado. Son ellos:
En el siguiente diagrama, representamos los tres estados físicos de la materia y los respectivos cambios de fase.

![Estados físicos fundamentales de la materia. Ilustración: OpenStax College [CC-BY 4.0] / vía CNX.org [adaptado]](https://definicionesyconceptos.com/wp-content/uploads/2021/10/Solidificacion-Cambio-de-estado-fisico-Fisica-y-quimica.jpg)




