Tabla de contenidos

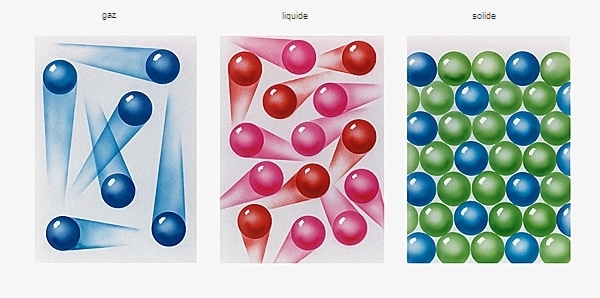
Mezcla homogénea formada por al menos dos sustancias.
QUÍMICA

Gran parte de la química tiene lugar en solución. De hecho, muy a menudo las reacciones químicas tienen lugar en solución por dos razones principales: por un lado, la disolución asegura un buen contacto entre los reactivos cuando no son naturalmente miscibles; y por otro lado, la disolución permite introducir cantidades de reactivos medidos con gran precisión (por ejemplo, durante ensayos o titulaciones); además, ofrece la posibilidad de controlar la velocidad de las reacciones actuando sobre las concentraciones.
1. Soluciones, solvente y soluto
En solución, la sustancia presente en mayor cantidad se denomina comúnmente disolvente. Se dice que la sustancia en cantidades más pequeñas está disuelta y se llama sustancia disoluta. El soluto puede ser un gas, un líquido, un sólido y el solvente puede ser líquido o sólido (→ estados de la materia). Las bebidas carbonatadas, que consisten principalmente en agua (solvente) y dióxido de carbono disuelto (soluto), o agua de mar (solvente) que contiene varias sales (solutos), son ejemplos de soluciones liquidas.
Las mezclas de gases, como la atmósfera, a veces se consideran soluciones; estamos hablando de soluciones carbonatadas.
Las soluciones difieren de los coloides y suspensiones, en las que las partículas de soluto son de tamaño molecular y se dispersan homogéneamente en el disolvente. Las soluciones parecen homogéneas bajo el microscopio y el soluto no se puede separar por filtración.
Algunos metales son solubles entre sí en estado líquido y se solidifican. Si tal mezcla puede solidificarse para diferentes proporciones de los dos metales (→ aleación), decimos que estos últimos forman una solución sólida.
2. Concepto de solubilidad

los solubilidad de un compuesto en un disolvente dado, a una temperatura y presión determinadas, es la cantidad máxima de compuesto que se puede disolver en la solución (→ disolución). En otras palabras, la solubilidad es igual a la concentración máxima (molar o masa) de un soluto en una solución. Cuando la concentración es igual a la solubilidad, la solución se dice saturado en soluto: ya no es posible disolver una cantidad adicional de soluto en él. Por ejemplo, si consideramos una solución acuosa que contiene azúcar disuelto, más allá de cierta cantidad de azúcar agregada a la solución, esta última ya no se disuelve: la solución está saturada de azúcar. Asimismo, en una marisma, la evaporación del agua aumenta la concentración de sal hasta la saturación, lo que permite su recolección.
En términos generales, la solubilidad de la mayoría de las sustancias aumenta con la temperatura del disolvente. Sin embargo, para algunas sustancias como los gases o las sales orgánicas de calcio, la solubilidad en un líquido aumenta al disminuir la temperatura. Además, las soluciones en las que las moléculas del soluto tienen una estructura química similar a las del disolvente generalmente tienen una solubilidad muy alta. Por ejemplo, alcoholes de fórmula general R – OH y el agua (HOH) son extremadamente solubles entre sí.
3. Características y propiedades físicas de las soluciones.
3.1. Concentración del soluto suministrado
La característica esencial de una solución es su concentración en sustancia disuelta (soluto) que se puede definir de las siguientes formas:
• masa de soluto por unidad de volumen de solución:
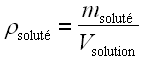
• número de moles de soluto por unidad de volumen de solución:
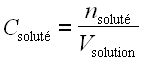
3.2. Características de una solución iónica y concentración efectiva de iones en solución.

Cuando un sólido iónico se disuelve en agua, se obtiene una solución acuosa iónica formada por aniones y cationes dispersos y que se mueven entre las muchísimas moléculas de agua.
Las soluciones iónicas son eléctricamente neutras pero conducen la corriente eléctrica porque tienen iones solvatados que son cargas móviles. Una solución conductora de electricidad se llama electrólito. Las soluciones acuosas iónicas son, por tanto, electrolitos.
Las soluciones iónicas se caracterizan mediante una fórmula que muestra el tipo y las proporciones de los iones presentes en el disolvente. Por ejemplo, la fórmula para la solución iónica de fluoruro de calcio es (Ca2+(aq) + 2 F–(aq)).
Finalmente, notamos [X] la concentración efectiva de un ion X presente en solución:
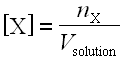
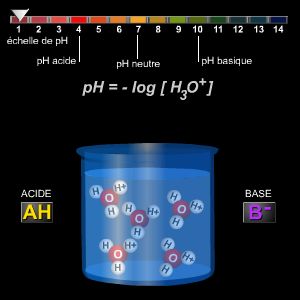
La concentración de iones de hidronio (H3O+) permite calcular el pH de una solución acuosa, es decir su carácter ácido o básico, mediante la fórmula pH = – log [H3O+].
3.3. Puntos de ebullición y congelación

Cuando se agrega un soluto a un solvente, ciertas propiedades físicas del solvente cambian: su punto de ebullición aumenta y su punto de congelación disminuye a medida que aumenta la concentración del soluto. Por ejemplo, un anticongelante como etano-1,2-diol (HOCH2CH2OH) en el agua de refrigeración de un motor para evitar que el agua se congele. Del mismo modo, un iceberg hecho de agua dulce permanece sólido mientras que a la misma temperatura el agua salada del mar no se congela.
3.4. Presión osmótica
Las soluciones tienen otra propiedad importante: pueden ejercer un presión osmótica. Si dos disolventes están separados por una membrana semipermeable (membrana que permite el paso de las moléculas de disolvente, pero que impide el paso de las moléculas de soluto), las moléculas de disolvente migran de la solución de menor concentración a la solución de mayor concentración. este último más diluido (fenómeno de ósmosis particularmente importante en fisiología y biología celular para explicar los intercambios químicos dentro de los organismos vivos).