Las soluciones químicas son mezclas homogéneas formadas por dos o más sustancias.
Los componentes de una solución se denominan soluto y solvente:
- Sustancia disoluta: representa la sustancia disuelta.
- Solvente: es la sustancia que se disuelve.
Generalmente, el soluto en una solución está presente en una cantidad menor que el solvente.
Un ejemplo de solución es la mezcla de agua y azúcar, con agua como disolvente y azúcar como soluto.
El agua se considera el solvente universal, debido a que disuelve una gran cantidad de sustancias.

Clasificación de soluciones
Como hemos visto, una solución consta de dos partes: el soluto y el solvente.

Sin embargo, estos dos componentes pueden tener diferentes cantidades y características. Como resultado, existen varios tipos de soluciones y cada una se basa en una determinada condición.
Cantidad de soluto
Según la cantidad de soluto que tengan, las soluciones químicas pueden ser:
- Soluciones saturadas: solución con la máxima cantidad de soluto totalmente disuelto por el solvente. Si se agrega más soluto, el exceso se acumula para formar un cuerpo inferior.
- Soluciones insaturadas: también llamado insaturado, este tipo de solución contiene menos soluto.
- Soluciones sobresaturadas: son soluciones inestables, en las que la cantidad de soluto excede la capacidad de solubilidad del solvente.

Estado fisico
Las soluciones también se pueden clasificar según su estado físico:
- Soluciones sólidas: formado por solutos y disolventes en estado sólido. Por ejemplo, la unión de cobre y níquel, que forma una aleación de metal.
- Soluciones liquidas: formado por disolventes en estado líquido y solutos que pueden estar en estado sólido, líquido o gaseoso. Por ejemplo, sal disuelta en agua.
- Soluciones gaseosas: formado por solutos y disolventes gaseosos. Por ejemplo, aire atmosférico.
Naturaleza del soluto
Además, según la naturaleza del soluto, las soluciones químicas se clasifican en:
- Soluciones moleculares: cuando las partículas dispersas en la solución son moléculas, por ejemplo, azúcar (molécula C12H22O11).
- Soluciones iónicas: cuando las partículas dispersas en la solución son iones, por ejemplo, la sal común cloruro de sodio (NaCl), formada por los iones Na+ y Cl–.
Para comprender la diferencia entre iones y moléculas, sugerimos estos textos:
Coeficiente de solubilidad
La solubilidad es la propiedad física de las sustancias para disolverse, o no, en un solvente dado.
El coeficiente de solubilidad representa la capacidad máxima del soluto para disolverse en una cierta cantidad de solvente. Esto depende de las condiciones de temperatura y presión.
Dependiendo de la solubilidad, las soluciones pueden ser:
- Soluciones diluidas: la cantidad de soluto es menor que la del solvente.
- Soluciones concentradas: la cantidad de soluto es mayor que la de solvente.
Cuando tenemos una solución concentrada, podemos notar que el soluto no se disuelve completamente en el solvente, lo que conduce a la presencia de un cuerpo de fondo.
Para calcular el coeficiente de solubilidad se utiliza la siguiente fórmula:
Dónde:
Cs: coeficiente de solubilidad
metro1: masa del soluto
metrodos: masa de disolvente
Concentración de soluciones
El concepto de concentración (C) está estrechamente relacionado con la cantidad de soluto y disolvente presente en una solución química.
Por tanto, la concentración de la solución indica la cantidad, en gramos, de soluto en un litro de solución.
Para calcular la concentración, use la siguiente fórmula:
Dónde:
C: concentración
metro: masa de soluto
V: volumen de la solución
En el Sistema Internacional (SI), la concentración se expresa en gramos por litro (g / L), la masa en gramos (g) y el volumen en litros (L).
¡Manténganse al tanto!
No debemos confundir el concepto de concentración (C) con el de densidad (d) de la solución:
| Concentración común | Densidad |
|---|---|
Para poner a prueba sus conocimientos de concentración y densidad, consulte los textos a continuación:
Dilución de soluciones
La dilución de las soluciones corresponde a la adición de más disolvente en una solución.
Como resultado, hemos pasado de una solución más concentrada a una solución más diluida.
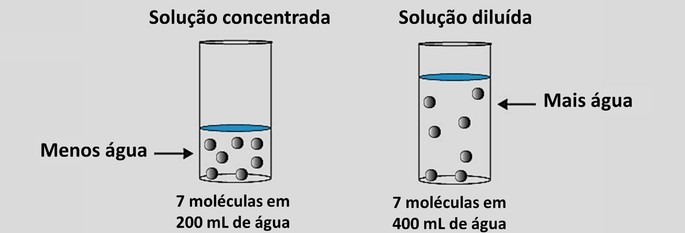
Es importante notar que el cambio ocurre en el volumen de la solución y no en la masa del soluto.
Entonces podemos concluir que cuando hay un aumento de volumen, la concentración disminuye. En otras palabras, el volumen y la concentración de una solución son inversamente proporcionales.
Para obtener más información, recomendamos leer estos textos.:
Ejercicios sobre soluciones químicas.
1. (Mackenzie) Un ejemplo típico de una solución sobresaturada es:
a) agua mineral natural.
b) suero casero.
c) refrigerante en un recipiente cerrado.
d) Alcohol 46 ° GL.
e) vinagre.
dos. (UFMG) Para limpiar una tela sucia de grasa, se recomienda utilizar:
a) gasolina.
b) vinagre.
c) etanol.
d) agua.
Obtenga más información sobre los problemas relacionados con este problema.:
3. (UFRGS) Una sal dada tiene una solubilidad en agua igual a 135 g / L, a 25 ° C. Al disolver completamente 150 g de esta sal en un litro de agua a 40 ° C, y enfriar lentamente el sistema a 25 ° C, se obtiene un sistema homogéneo cuya solución será:
a) diluido.
b) concentrado.
c) insaturados.
d) saturado.
e) sobresaturados.
4. (UAM) Si disolvemos por completo cierta cantidad de sal en un solvente y por alguna perturbación se deposita una parte de la sal, ¿qué solución tendremos al final?
a) saturado con cuerpo inferior.
b) sobresaturada con cuerpo inferior.
c) insaturados.
d) sobresaturados sin cuerpo inferior.
e) saturado sin cuerpo de fondo.
5. (UNITAU) Al carbonatar un refresco, las condiciones bajo las cuales se debe disolver el dióxido de carbono en la bebida son:
a) cualquier presión y temperatura.
b) alta presión y temperatura.
c) baja presión y temperatura.
d) baja presión, alta temperatura.
e) alta presión y baja temperatura.