Tabla de contenidos
La sublimación es el cambio de estado sólido a gaseoso y viceversa, sin pasar por un estado líquido.
Para que una sustancia se someta al proceso de sublimación es necesario que esté sometida a ciertos valores de temperatura y presión.
Naftaleno y COdos sólidos (hielo seco) son ejemplos de sustancias que se someten a sublimación en condiciones ambientales.

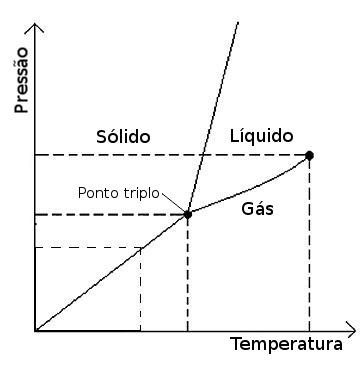
Diagrama de fases
Podemos conocer el estado físico de una sustancia conociendo los valores de temperatura y presión a los que está sometida.
Para eso, usamos diagramas construidos para cada sustancia, a partir de valores encontrados experimentalmente.
Llamado «diagrama de fase», se divide en tres regiones que representan los estados sólido, líquido y gaseoso. Las líneas que delimitan estas regiones señalan los puntos en los que la sustancia cambia de fase.
El punto triple del diagrama indica la temperatura y la presión a las que la sustancia puede coexistir en las tres fases. Debajo de ese punto está la curva de sublimación.
Los puntos de esta curva determinan los valores de presión y temperatura a los que se producirá la sublimación.
Cuando un sólido se somete a una presión menor que la del punto triple, si se calienta pasará directamente al estado gaseoso.
El cambio del estado sólido directo al estado gaseoso, también puede ocurrir al disminuir la presión cuando su temperatura es menor que la del punto triple.
Obtenga más información en: Cambios en el estado físico.
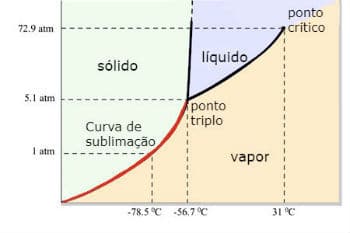
Diagrama de fases de dióxido de carbono (CO)dos )
El punto triple del COdos ocurre cuando la presión es de 5 atm. Este hecho justifica ser común, vemos la ocurrencia de sublimación en hielo seco, ya que la presión ambiental es de 1 atmósfera.
Por esta razón, no se obtiene dióxido de carbono líquido en condiciones ambientales. En estas condiciones, está en estado sólido o en estado de vapor.
Diagrama de fase de dióxido de carbono
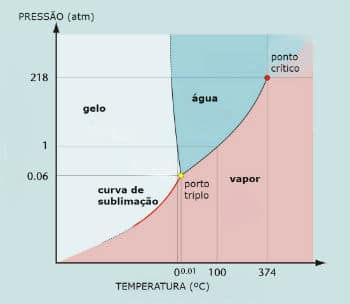
Diagrama de fases del agua (HdosO)
El punto triple del agua ocurre cuando la presión es de solo 0.06 atm. Por lo tanto, en condiciones ambientales, la sublimación de agua no es común.
Diagrama de fase del agua
Sublimación de hielo seco. Foto: Ratthaphong Ekariyasap / Shutterstock.com
Este gráfico describe, para un determinado material, las transiciones de fase según la evolución de la temperatura y la presión. Se puede observar que existe un punto en el gráfico donde coexisten en equilibrio los tres estados fundamentales (sólido, líquido y gas), el llamado punto triple. La presión en este punto se llama presión de vapor, y puede ver que a presiones por debajo de esta, un aumento de temperatura hace que el material pase de la fase sólida directamente a la fase de vapor. El mismo efecto se observa cuando, bajo una temperatura por debajo del punto triple, la presión es alta.