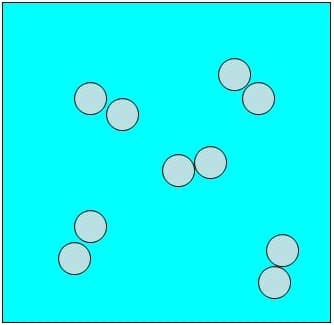
Las sustancias puras (que solo tienen un componente) se pueden dividir en simple y compuesto.
Sustancia pura simple
Está formado por un solo tipo de elemento, en forma de iones iguales.
Ejemplos: Hdos (Gas hidrógeno), Ndos (gas nitrógeno), Odos (gas oxígeno).
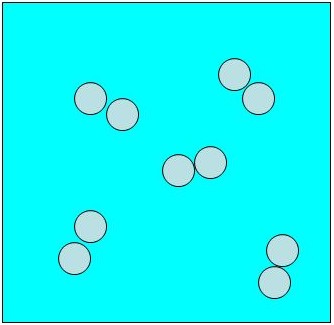
Representación con átomos simbolizados por bolas para la molécula de Hdos.
En algunos casos, un mismo elemento puede formar diferentes sustancias simples según cómo se combine, formando alótropos. Este es el caso del oxígeno, que forma O2 (gas oxígeno) y O3 (gas ozono).
Muchos elementos de la tabla periódica existen como sustancia pura. La mayor parte de la Tabla forma sustancias puras en estado físico sólido (en el caso de los metales, por ejemplo) y gaseoso (en el caso del oxígeno gaseoso, por ejemplo). Las únicas dos sustancias líquidas puras y simples son el mercurio y el bromo.
Las sustancias simples se pueden clasificar en monoatómicas, diatómicas, triatómicas, etc. como vemos a continuación:
sustancia compuesta pura
Puede estar formado por más de un tipo de elemento, en forma de iones diferentes. No hay límite para el número de átomos que forman una sustancia compuesta.
Ejemplos: COdos (dióxido de carbono), NaCl (cloruro de sodio), HdosO (agua).
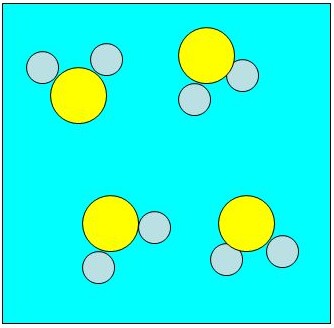
Representación con átomos simbolizados por bolas para la molécula de HdosO.
Al igual que en las sustancias puras, en los composites también existe la posibilidad de que dos elementos formen, según la proporción entre ellos, sustancias diferentes. En este caso no se llama alotropía ya que es solo una combinación diferente de átomos. Pero es necesario tener en cuenta que para ser una sustancia pura, la composición no puede variar.
Ejemplo: HdosO (agua) y HdosOdos (agua oxigenada).
Tenga en cuenta que ambas sustancias tienen hidrógeno y oxígeno, pero no son lo mismo.
Una peculiaridad de algunas sustancias compuestas es la capacidad de descomponerse en sustancias simples. El agua (HdosO), por ejemplo, puede descomponerse en oxígeno gaseoso e hidrógeno gaseoso por electrólisis, así como cloruro de sodio (NaCl) que, en su estado fundido, al pasar una corriente eléctrica, sufre una reacción de oxidación-reducción que dará lugar a dos sustancias simples, sodio metálico (Na) y cloro gaseoso (Cldos).
Bibliografía:
Atkins, PW, Jones, L., Principios de la química: cuestionando la vida moderna y el medio ambiente, 5a ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química General, 12a ed., São Paulo: Saraiva, 2006.
http://docente.ifsc.edu.br/michael.nunes/MaterialDidatico/Analises%20Quimicas/Quimica%20Geral/substacncias-puras-e-misturas-parte-1.pdf
http://www2.eesc.usp.br/netef/Oscar/Aula4t.pdf