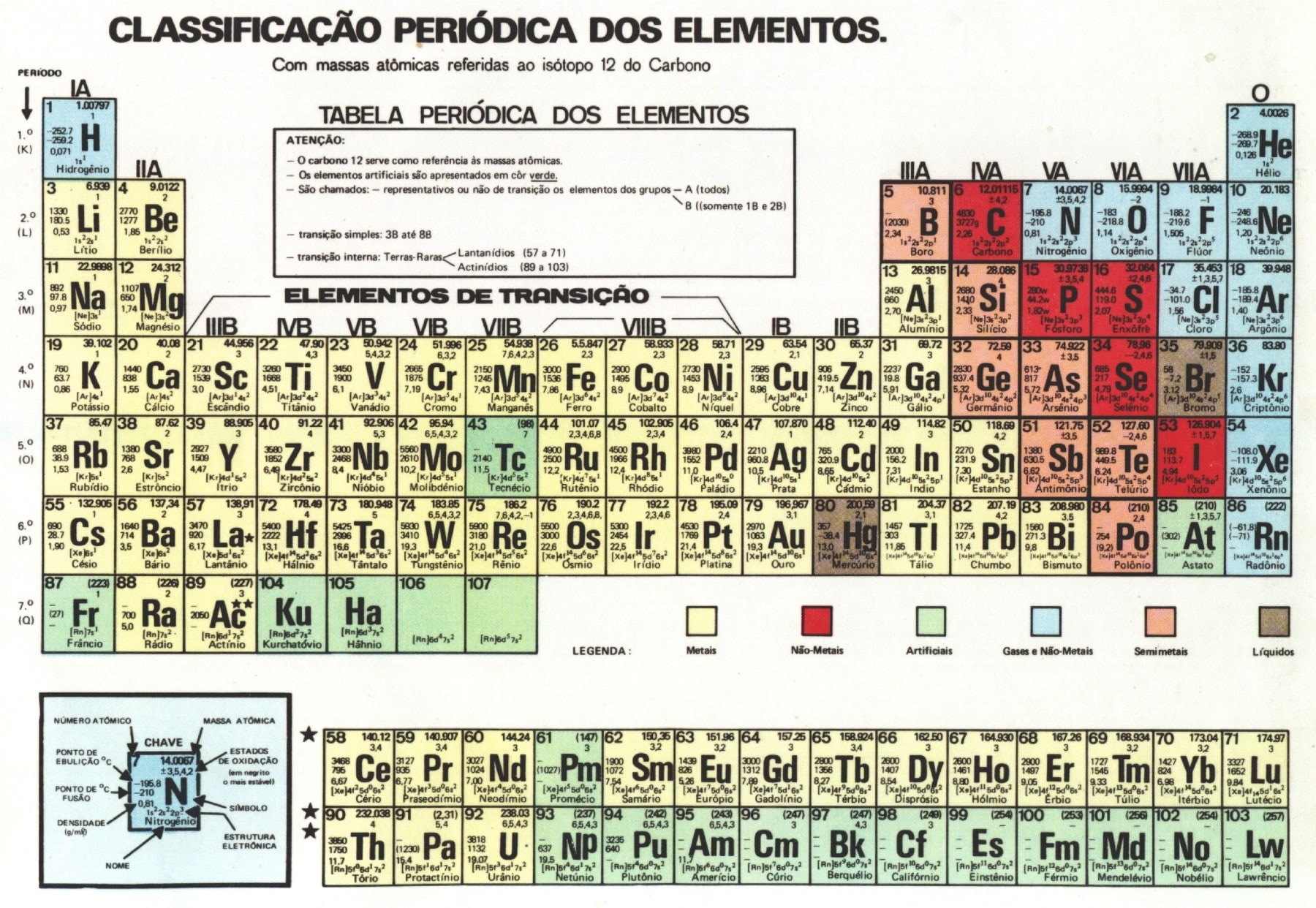
En Química, los criterios utilizados para la organización de los elementos químicos se establecieron a lo largo del tiempo. En el año 1869, Dimitri Mendeleev inició sus estudios sobre la organización de la tabla periodica a través de un libro sobre los aproximadamente 60 elementos conocidos en ese momento, cuyas propiedades había anotado en tarjetas separadas. Al trabajar con estos datos, se dio cuenta de que al organizar los elementos según la masa de sus átomos, ciertas propiedades se repetían varias veces, y con la misma proporción, por lo tanto era una variable periódica. Recordando que periódico es todo lo que se repite en intervalos de tiempo bien definidos, como las estaciones del año y las fases de la luna, por ejemplo.
Fue creado con el fin de organizar la información ya encontrada para facilitar el acceso a los datos. Cuando se propuso, aún no se habían descubierto muchos elementos, aunque su principio todavía se sigue hoy con 118 elementos. Se han propuesto algunos otros modelos de mesa, como el que propone Philip Stewart en forma de espiral en base a la naturaleza cíclica de los elementos químicos, pero el más utilizado sigue siendo el de Mendeleev.
Dimitri Ivanovich Mendeleev nació en Siberia y era profesor en la Universidad de San Petersburgo cuando descubrió el derecho periódico. El elemento del número atómico 101 en la tabla periódica lleva su nombre, Mendelevio.
La tabla tiene los elementos químicos ordenados en orden ascendente de número atómico y están divididos en grupos (o familias) debido a características que son comunes entre ellos. Cada elemento químico está representado por un símbolo, por ejemplo, la plata está representada por Ag debido a su nombre latino. argentum. Cada elemento tiene el número atómico y el número de masa al lado de su símbolo.
clasificación de elementos
- Metales: Son buenos conductores de calor y electricidad. Son sólidos en CNTP (excepto mercurio), además de maleables y dúctiles.
- No metales: Son malos conductores de corriente eléctrica y calor. Pueden asumir cualquier estado físico a temperatura ambiente.
- Gases nobles: Tienen baja reactividad, siendo considerados inertes hasta hace poco.
Los elementos se pueden clasificar en representativos o transitorios (internos y externos). Representantes son aquellos cuya distribución electrónica termina en s o PAG. Los elementos exteriores de transición son aquellos cuya distribución termina en D, y las transiciones internas terminan en F. La ubicación de un elemento en la tabla periódica se puede indicar por su grupo y período. Los elementos de transición internos son los que se encuentran en las dos filas en la parte inferior de la tabla y, de hecho, es como si estuvieran ubicados en el sexto y séptimo períodos del grupo tres.
Cada fila de la tabla periódica representa un curso del tiempo. Son siete en número, y el período en el que se encuentra el elemento indica el número de niveles que tiene. Por ejemplo, el sodio (Na) está en el período tres, lo que significa que su átomo tiene tres capas de electrones.
Los grupos, en cambio, son líneas verticales que presentan elementos químicos que comparten propiedades. Por ejemplo, el flúor (F) y el cloro (Cl) están en el grupo 17 (o 7A) porque tienen una alta tendencia a recibir electrones, lo que llamamos electronegatividad. Algunos grupos tienen nombres específicos como los que se enumeran a continuación y los demás llevan el nombre del primer elemento de su grupo.
Grupo 1: Metales alcalinos: estos elementos son muy reactivos especialmente con el agua. Esta reactividad aumenta a medida que aumentan el número atómico y el radio del átomo. Todos los elementos de este grupo son electropositivos, buenos conductores de electricidad y forman cimientos sólidos. Son sólidos a temperatura ambiente, tienen un brillo metálico y cuando se exponen al aire se oxidan fácilmente. Se utilizan en iluminación en el caso de las lámparas de sodio, en la depuración de metales y en la fabricación de jabones, combinándose con grasas.
Grupo 2: Metales alcalinotérreos: Tienen este nombre porque generalmente se encuentran en la tierra. Son muy reactivos, pero menos que los metales del grupo 1. También son electropositivos y son más duros y densos que los metales alcalinos. Se utilizan en aleaciones metálicas como el berilio (Be), en la composición de yeso y mármol, en el caso de calcio (Ca) y magnesio (Mg) y estroncio (Sr) en fuegos artificiales.
Grupo 16 (o 6A): Calcógenos: Los elementos de este grupo reciben este nombre derivado del griego que significa “formadores de cobre”. En este grupo, la presencia de características metálicas y no metálicas se puede ver fácilmente analizando todos los elementos del grupo. Los elementos más importantes de este grupo son el oxígeno (O) y el azufre (S), siendo el primero el gas utilizado incluso en nuestra respiración y el segundo responsable del fenómeno de la lluvia ácida.
Grupo 17 (o 7A): Halógenos: Son los elementos más electronegativos de la tabla periódica, es decir, tienden a recibir electrones en un enlace. Pueden combinarse con casi cualquier elemento de la tabla periódica. El fluoruro, por ejemplo, tiene aplicación en la higiene bucal.
Grupo 18 (u 8A): gases nobles: tienen este título porque se observó anteriormente que no tenían tendencia a formar enlaces. Esto se debe a la estabilidad de sus orbitales más externos completamente llenos. Hoy en día algunos compuestos han logrado prepararse con estos elementos y generalmente incluyen Xenon (Xe) que tiene la primera energía de ionización muy cercana al oxígeno.
Lea mas:
Exámenes de ingreso y exámenes
Pregunta 01: (UDESC 2008)
En 1869 Dimitri Mendeelev (1834-1907) introdujo la ley periódica de los elementos a la comunidad científica. Seguro de la vigencia de su clasificación, dejó posiciones vacías en la tabla, por elementos que se descubrirían. Predijo, con sorprendente precisión, sus propiedades; para ello, tomó como base las propiedades de los elementos vecinos, habiendo basado la clasificación periódica actual de los elementos. Con base en las propiedades periódicas de los elementos, revise la información a continuación.
I – Los elementos de Block s tienen baja energía de ionización; sus electrones se pierden fácilmente.
II – Las energías de ionización de los elementos del bloque p son menores que las de los elementos del bloque s.
III – Todos los elementos del bloque d son metales, sus propiedades son intermedias a los elementos del bloque s y p.
Comprobar la alternativa correcta.