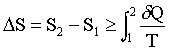Tabla de contenidos

Rama de la física que estudia las propiedades de los sistemas involucrando los conceptos de temperatura y calor.
La termodinámica es esencialmente el resultado del trabajo de S. Carnot, quien enunció el «segundo principio» en 1824, de Joule, quien enunció el «primer principio» en 1840, y de Clausius (1850). La descripción de los sistemas termodinámicos está vinculada a la noción de sistema y D ‘Expresar de este sistema. Las ecuaciones de estado especifican las relaciones entre las diversas variables de un sistema dado. Así, las variables intensivas (que no dependen del tamaño del sistema) de un gas ideal, presión pags y temperatura T, se relacionan con las variables extensivas (que dependen de su tamaño), volumen V y número de moléculas N, por la ecuación pags V = NRT, donde R es la constante del gas ideal. Los cambios en el estado de un sistema, que pueden deberse a un intercambio de trabajo y / o calor con el ambiente externo, generalmente resultan en un estado de equilibrio, caracterizado por constantes variables en el tiempo. Cuando un sistema no puede intercambiar material, trabajo o calor con el exterior, se dice que está “aislado”. Los principios de la termodinámica. permiten predecir la evolución macroscópica de los sistemas y sus estados de equilibrio. “Dos cuerpos en equilibrio térmico con el mismo tercio están en equilibrio térmico entre ellos. «. Existe una función U (la energía interna) cuya variación durante una transformación depende solo del estado inicial y del estado final. Para un sistema cerrado, esta variación se escribe ΔU = W + Q, donde W es el trabajo y Q la cantidad de calor que recibe el sistema. Las cantidades W y Q son algebraicas. Para la física estadística, la energía interna se define como la suma de las energías cinética y de interacción de sus componentes microscópicos; el primer principio entonces simplemente establece la conservación de la energía. Expresa la irreversibilidad de los procesos macroscópicos espontáneos. Hay muchas declaraciones, todas equivalentes, del segundo principio:
, donde δQ es la cantidad de calor que recibe el sistema cuando su temperatura es T. Esta relación se convierte en una igualdad cuando la transformación es reversible. La evolución espontánea de un sistema aislado, por tanto, siempre resulta en un aumento de su entropía, ya que la cantidad de calor que recibe es cero. El estado de equilibrio termodinámico de un sistema es el estado compatible con las restricciones externas para las cuales la entropía toma el valor máximo. A temperatura 0 K, la entropía de todos los sistemas es cero. Los dos primeros principios se expresan en forma matemática escribiendo que la función de estado característica del sistema es diferencial. Las funciones de estado más utilizadas son la energía interna U y la entalpía H. Las relaciones obtenidas permiten predecir el comportamiento de los sistemas termodinámicos.
Principio cero
Primer principio
Segundo principio (o principio de Carnot)
– Declaración de Clausius: no existe ningún proceso cuyo único efecto sea transferir calor de una fuente fría a una fuente caliente;
– Declaración de Kelvin: no existe un motor térmico que pueda proporcionar trabajo a partir de una sola fuente de calor;
– formulación usando entropía: durante una transformación, la variación de entropía ΔS depende solo del estado inicial y del estado final y verifica la relación: Tercer principio