Tabla de contenidos
Las transformaciones adiabáticas son cambios que ocurren en una masa de gas sin intercambio de calor.
El término adiabático se origina en el griego adiabates y significa intransitable. El proceso adiabático puede ocurrir en dos situaciones:
- El sistema está aislado y los límites que lo rodean evitan que se produzca la transferencia de calor al entorno externo.
- El sistema y el vecindario tienen la misma temperatura y, por lo tanto, no existen diferencias que permitan la transferencia de calor.
Para crear un sistema aislado adiabáticamente, el contenedor debe estar aislado térmicamente.
Transformación adiabática y la primera ley de la termodinámica
La Primera Ley de la Termodinámica también se denomina principio de conservación de energía, que relaciona la participación del trabajo () y calor (Q) en la variación de energía interna (U) de un sistema.
Como en la transformación adiabática no hay intercambio de calor con el ambiente, entonces Q = 0 e:
A través de la fórmula podemos ver que el módulo de la variación energética del sistema corresponde al módulo del trabajo realizado entre el sistema y el barrio.
Aviso! Un proceso adiabático no es lo mismo que una transformación isotérmica. En este último, el prefijo Yo asi indica que la cantidad de temperatura es constante.
En la transformación adiabática, la temperatura puede variar con el desempeño del trabajo. El trabajo es responsable de la energía suministrada o concedida por el sistema.
Obtenga más información sobre la Primera Ley de la Termodinámica.
Ejemplos de transformaciones adiabáticas
En la práctica, las transformaciones adiabáticas son muy fáciles de producir. Vea dos ejemplos a continuación.
Expansión de un gas
En la expansión adiabática, el gas puede desplazar el pistón utilizando su energía interna.
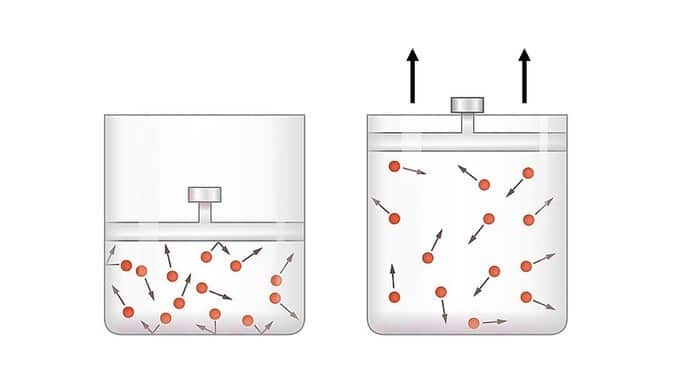
La energía aportada por el gas se mide por el trabajo para que se produzca la transformación. Cuando el sistema funciona, el trabajo es positivo y la variación de energía es negativa
.
En este caso, la energía interna del sistema disminuye proporcionalmente al trabajo realizado, ya que el trabajo se realiza utilizando la energía interna del sistema.
La expansión adiabática se utiliza para enfriar gases, ya que la temperatura del sistema disminuye y el gas se enfría, ya que ha perdido parte de su energía interna.
En la práctica, podemos observar la expansión de un gas adiabáticamente cuando presionamos un desodorante sobre rociar. Cuando tocas el material que se expande desde la salida, notas que está frío.
Lea también: Estudio de gases
Compresión de un gas
En compresión adiabática, el pistón es desplazado por energía del ambiente externo.
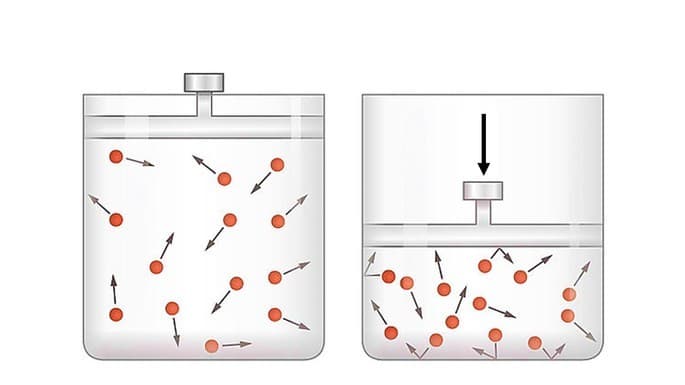
Cuando el sistema recibe trabajo, el trabajo es negativo y la variación de energía es positiva
.
En este caso, la energía interna del sistema aumenta proporcionalmente al trabajo recibido, ya que el sistema está recibiendo energía del entorno externo.
Se observa que el sistema se calienta al elevar la temperatura en la rápida compresión de un gas.
En la práctica, la compresión de un gas adiabáticamente se puede percibir cuando utilizamos una bomba de aire para inflar un neumático de bicicleta. Al tocar el material, sentimos que el extremo de la bomba se calienta.
Lea también: Ley de los gases
Transformaciones adiabáticas: variación de presión y volumen
Las cantidades de presión y volumen en las transformaciones adiabáticas están relacionadas por la Ecuación de Poisson:
Dónde,
p: presión de gas;
V: volumen de gas;
y: exponente o razón de Poisson.
El exponente de Poisson se calcula por la relación entre los calores específicos con la presión (CPAG) y volumen (Cv) constante.
El valor del coeficiente depende solo de la atomicidad del gas. Por ejemplo, un gas monoatómico, como el helio (He), tiene y igual a 1,7. Un gas diatómico, como el oxígeno (Odos), tiene un valor de y igual a 1,4.
Obtenga más información sobre las transformaciones de gas.
Gráfico de transformaciones adiabáticas
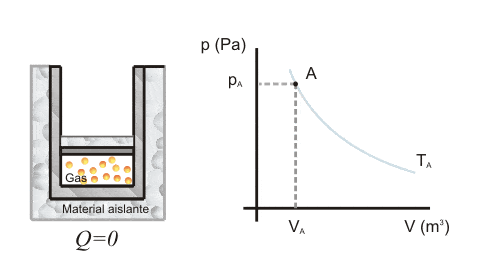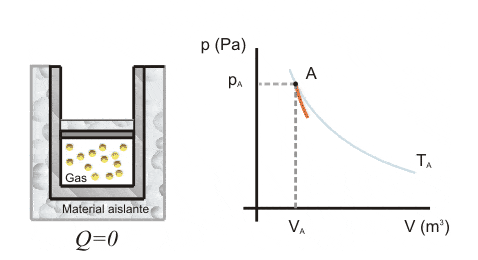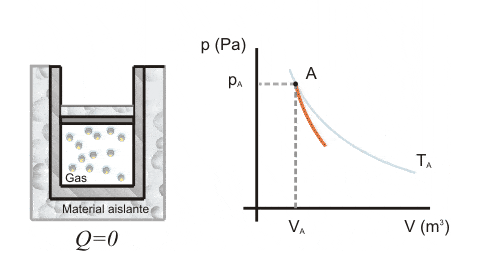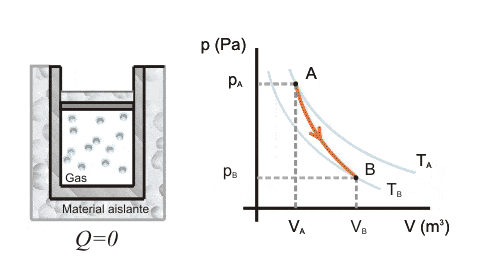
Como la razón de Poisson es mayor que 1, el diagrama de presión y volumen en las transformaciones adiabáticas forman hipérboles.
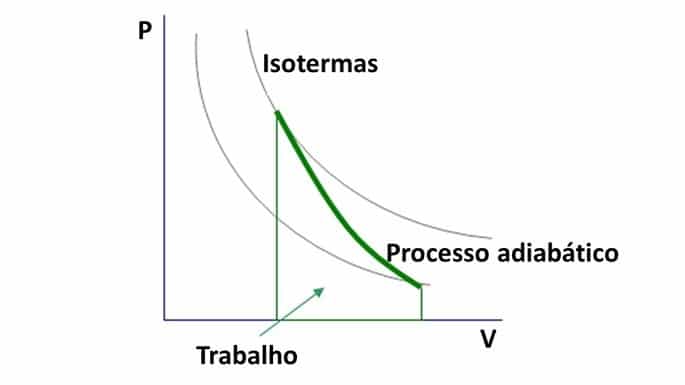
La curva de transformación adiabática interseca las curvas isotérmicas, que corresponde al gráfico de presión y volumen en las transformaciones isotérmicas. .
Ejercicios sobre transformaciones adiabáticas.
Pregunta 1
En una expansión adiabática, un gas ideal intercambia la energía de 209 J con el entorno de trabajo. Determine la cantidad de calor que el sistema intercambia con el ambiente externo en esta transformación.
Pregunta 2
Al expandirse adiabáticamente, partiendo de una presión inicial de 2.0 atm y un volumen de 2.0 l, un gas duplica su volumen. Determine la presión final del gas usando el coeficiente de Poisson y = 2.0.
a) 1.0 atm
b) 1,5 ATM
c) 0.5 atm
d) 2,0 atmósferas
Obtenga más conocimientos leyendo también sobre Transformación isobárica.
Referencias bibliográficas
ÇENGEL, YA; BOLES, MA Termodinámica. 7ª ed. Porto Alegre: AMGH, 2013.
HELOU; GUALTER; NEWTON. Temas de física, vol. 2. São Paulo: Editora Saraiva, 2007.