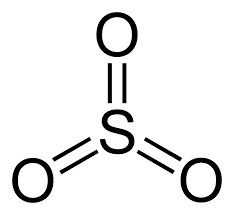
O trióxido de azufre es una molécula formada por dobles enlaces covalentes entre átomos de S y O, cuya fórmula molecular es SO3. Tiene una geometría trigonal plana con ángulos de 120º entre los enlaces S = O, por lo que el momento dipolar de la molécula es cero, lo que le confiere un carácter apolar. También se conoce como anhídrido sulfúrico o óxido sulfúrico, y el átomo de azufre tiene un estado de oxidación +6 y una carga formal +3. La molécula de SO3 tiene una masa molecular de 80.06 g / mol, y sus puntos de fusión y ebullición son 16.9 ºC y 45 ºC respectivamente. A temperatura ambiente se puede encontrar en forma de líquido ahumado incoloro con una densidad de 1,92 kg / m3. En forma gaseosa, es un compuesto contaminante, irritante y corrosivo, siendo una de las principales causas de la lluvia ácida. Entre los problemas de salud provocados por el SO3 hay enfermedades respiratorias, especialmente bronquitis y, en casos más graves, enfisema pulmonar y problemas cardiovasculares. Es un compuesto estable, pero incompatible con materia orgánica, metales, bases y cianuros que reaccionan fuertemente con agua y oxígeno. Es muy higroscópico, y su calor de hidratación puede provocar la ignición de la madera o el algodón, ya que deshidrata los carbohidratos presentes en las estructuras de estos materiales.
El sistema operativo3 se obtiene mediante la reacción de dióxido de azufre (SOdos) purificado con oxígeno atmosférico (temperatura de 400 a 600 ºC) en presencia de pentóxido de vanadio (VdosO5) como catalizador de la reacción. Este proceso se denomina contacto directo y el catalizador se activa con óxido de potasio en apoyo de tierra de diatomeas o sílice.
Esta reacción es reversible y ocurre lentamente a una temperatura controlada, sin embargo, el aumento de temperatura puede desplazar el equilibrio hacia la producción de SO.dos es eldos. Para hacer la reacción más rápida, sin pérdida de SO3, es posible añadir catalizadores a base de nitrato de potasio.
SOLOdos + NOdos → ASÍ3 + NO
También se puede obtener mediante la combustión de compuestos sulfurosos que se forman en las chimeneas de las fábricas. En el laboratorio se puede producir mediante la reacción de pirólisis de bisulfato de sodio (NaHSO4).
Deshidratación a 315ºC: 2 NaHSO4 → ActivadodossdosO7 + HdosO
Agrietamiento a 460ºC: NadossdosO7 → ActivadodosSOLO4 + SO3
El SO3 se considera un ácido de Lewis, recibe electrones, siendo un ácido más fuerte que el SOdos, y con esto reacciona directamente con el agua formando ácido sulfúrico (HdosSOLO4).
SOLO3 (g) + HdosO(l) → HdosSOLO4 (l)
Esta reacción explica por qué el sistema operativo3 es uno de los gases que contribuye al problema de la lluvia ácida, ya que la presencia de HdosSOLO4, que es un ácido fuerte, disminuye el pH del agua de lluvia. Esto provoca una serie de problemas, ya que modifica el pH de los medios acuáticos, suelos, provocando desequilibrios en estos ecosistemas. Además, la lluvia ácida causa daños a las ciudades al destruir monumentos, edificios, puentes, vehículos e incluso pintura por el proceso de corrosión.
Debido a los problemas ambientales y de salud causados por SO3 está presente en la lista de indicadores de calidad del aire del Consejo Nacional del Ambiente (CONAMA).
Referencias:
Atkins, PW; Jones, Loretta. Principios de la química: cuestionar la vida moderna y el medio ambiente. Volumen único. 3. ed. Porto Alegre: Bookman, 2006.
Cardoso, AA; Pitombo, LRM Contribución de compuestos reducidos de azufre al equilibrio general de la reserva de azufre ambiental. Nueva química, v. 15, pág. 219, 1992.
Air Quality Indicators National Environmental Council (CONAMA) disponible en http://www.mma.gov.br/port/conama/ consultado en abril de 2019.
Kotz, JC Química general y reacciones químicas. Volumen 1, 9a edición, Cengage Learning, 2015.
Titus y Canto. Química en el enfoque cotidiano. Volumen único, partes A y C – Química orgánica. Editora Saraiva 2005.
Silva, LA; Carvalho, LS; Lopes, WA; Pereira, PA de Paulo .; Andrade, JB Solubilidad y reactividad de gases. Química Nova, Vol. 40, No. 7, 824-832, 2017