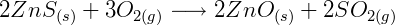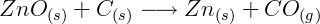el elemento zinc, ya conocida por civilizaciones antiguas como la griega y la romana, fue redescubierta oficialmente en el siglo XVIII. El nombre zinc posiblemente se originó a partir del término alemán, zinc. El término zinc, a su vez, puede haberse derivado de una corrupción del término persa cantar, que significa piedra. Independientemente del origen del nombre, se sabe que el metal se conoce desde hace al menos dos mil años, siendo las primeras grandes civilizaciones occidentales en identificarlo como un metal diferente a los demás disponibles en ese momento. En la India, se encontraron plantas industriales rudimentarias, donde los minerales de zinc se procesaron a gran escala durante más de cuatrocientos años.
Fue en China donde la producción de zinc alcanzó su punto máximo, ya que los chinos desarrollaron el proceso de producción y refinación a gran escala de este metal. Documentos del siglo XVIII atestiguan que un barco de la Compañía India se hundió frente a las costas de la actual Suecia, con un cargamento de zinc chino, de gran pureza, como se atestiguó más tarde.
Hasta mediados del siglo XVIII, la comunidad científica europea no había determinado la identidad química del elemento zinc. Aunque existen algunas controversias históricas, a Andreas Marggraf se le concedió el “descubrimiento” del zinc, mediante la reacción de reducción de uno de sus minerales con carbón vegetal.
obtención
El zinc metálico se puede extraer de varios minerales, como la calamina (silicato que contiene zinc), la mezcla (sulfato de zinc – ZnS) y la smithsonita (carbonato de zinc – ZnCO3) algunos de los minerales de interés. Las mayores reservas de zinc se encuentran en China, Australia y Perú y están en producción.
La obtención de zinc metálico a partir del sulfuro de zinc se inicia mediante el tostado del mineral, que consiste en calentar el mineral en una atmósfera rica en aire para producir óxido de zinc, de acuerdo con la siguiente ecuación:
Este óxido de zinc se reducirá luego con carbón vegetal, formando zinc metálico y monóxido de carbono, de acuerdo con la siguiente ecuación:
Aunque la vía pirometalúrgica se utiliza a gran escala, el zinc se puede obtener mediante la electrólisis de sus sales, proceso más caro que el mencionado anteriormente.
aplicaciones
El elemento zinc es un micronutriente de crucial importancia para los seres vivos, ya que está presente en el sitio activo de más de quince enzimas. Al estar presente en los alimentos, la cantidad de este micronutriente se repone constantemente en nuestro organismo.
El zinc metálico se utiliza como metal de sacrificio, con el objetivo de corroerlo en lugar del metal que es interesante proteger, como el hierro y las aleaciones de acero, metales importantes en el sector de la construcción civil. Sus aleaciones metálicas se comportan muy bien, como es el caso del latón, destinado en su mayoría a la producción de automóviles.
Su óxido es importante en el sector industrial de pigmentos y pinturas, y en varios otros sectores productivos (farmacéutico, cosmético, textil), siendo un componente importante de pilas y baterías. El maquillaje blanco de varios artistas circenses está compuesto por óxido de zinc en una emulsión cremosa, lo que indica los diferentes usos de este material. El sector de la galvanización industrial utiliza sales de zinc para proteger los metales menos nobles, utilizando para ello conceptos de electrólisis.
El zinc tiene una valencia de Zn2+, siendo considerado un metal de carácter anfótero.
Referencias bibliográficas::
Tabla periódica virtual UNESP: http://www2.fc.unesp.br/lvq/LVQ_tabela/030_zinco.html
Aplicación «Tabla periódica» – Real Society of Chemistry (RSC)
FELTRE, R. Química General – 5ª Ed. – São Paulo: Moderna, 2000. p.510 – 511.
STRATHERN, P. El sueño de Mendeleev: la verdadera historia de la química. (traducción de Maria Luiza X. de A. Borges). Ed. Zahar. 2002.
KEAN, S. La cuchara que desaparece. (traducción de Cláudio Carina). Ed. Zahar. 2011.