O coeficiente de solubilidad es la cantidad de soluto necesaria para saturar el disolvente a una determinada temperatura y presión.
En cuanto a la solución, se debe tener en cuenta que cuanto mayor sea la cantidad de soluto, más concentrada estará la solución. Además, cada sustancia está saturada en una cierta cantidad de disolvente.
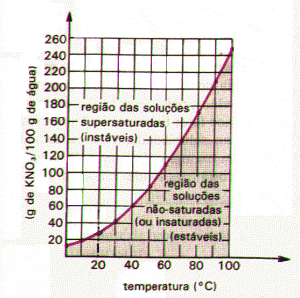
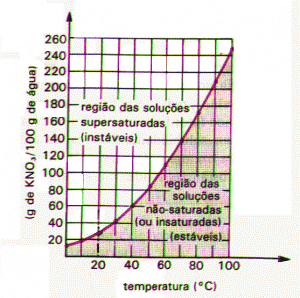
Las soluciones saturadas también pueden precipitarse, cuando su cantidad de soluto es mayor en relación a su coeficiente de solubilidad, y sobresaturadas, cuando la cantidad de soluto es mayor en relación al coeficiente de solubilidad, sin embargo, algún factor externo, como el calentamiento, puede disolverse. exceso. Una sustancia dada puede tener diferentes solubilidades a diferentes temperaturas.
El coeficiente de solubilidad es útil cuando se analiza que habrá un exceso de soluto cuando sus moléculas ya no puedan formar enlaces, ya que no habrá suficientes moléculas de solvente para interactuar con las moléculas de soluto. También hay una diferencia en la solubilidad del mismo soluto en diferentes disolventes.
La fórmula para calcular el coeficiente de solubilidad es: m1 / Cs = m2 / 100
Ejemplo: A 50 ° C es posible disolver un máximo de 80 g de Ba (NO3) 2 en 100 g de agua. Entonces, este es el coeficiente de solubilidad de esta sal, a esta temperatura.
Cs = 80 g / 100 g de H2O.
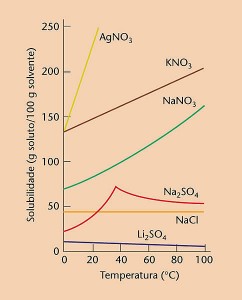
La solubilidad de la mayoría de las sustancias aumenta al aumentar la temperatura. Los gases, sin embargo, tienen su solubilidad reducida.
En la figura anterior, la sustancia más soluble a 20º C es AgNO3. la solubilidad del NaNO3 a 40ºC es de 100g / 100g de H2O.
Además, la siguiente solución de ejercicio demuestra el cálculo del coeficiente de solubilidad:
La solubilidad de una sal varía linealmente con la temperatura. A 30º C, 30 g de esta sal forman 180 g de una solución saturada con agua. Una solución de este tipo, cuando se calienta a 70ºC, requiere la adición de otros 45 g de sal para mantener la saturación. Calcule las C de la sal:
- a) a 30 ° C
- b) a 70º C
- c) a 50 ° C
Deje 100 g como cantidad estándar de agua.
Resolución:
a) 30 ° C
Si hay 30 g de sal y 180 g de solución, tiene 150 g de agua.
150 g de agua —- 30 g de sal
100 g de agua —- x
150 veces = 3000
x = 20 g de sal
Cs de sal a 30 ° C = 20g / 100ml
B)
70 ° C
30g + 45g = 75g de sal y 150g de agua
150 g de agua —– 75 g de sal
100 g de agua —– x
150x = 7500
x = 50 g de sal
Sal Cs a 70 ° C = 50g / 100ml
C)
30 ° C —- 20g
50 ° C —– x
30x = 1000
x = 33,3 g / 100 ml
Respuestas:
a) Cs a 30 ° C = 20g / 100ml
b) Cs a 70 ° C = 50g / 100ml
c) Cs a 50 ° C = 33,3 g / 100 ml
Así, arriba está el cálculo del coeficiente de solubilidad de una sal a tres temperaturas diferentes. Tenga en cuenta que el resultado final también cambia.
Lea también:
Fuentes:
CRUZ, Roca. Experimentos de química. São Paulo: Biblioteca de Física. 2004.
Coeficiente de solubilidad. Disponible en
Resolución del problema. Disponible en