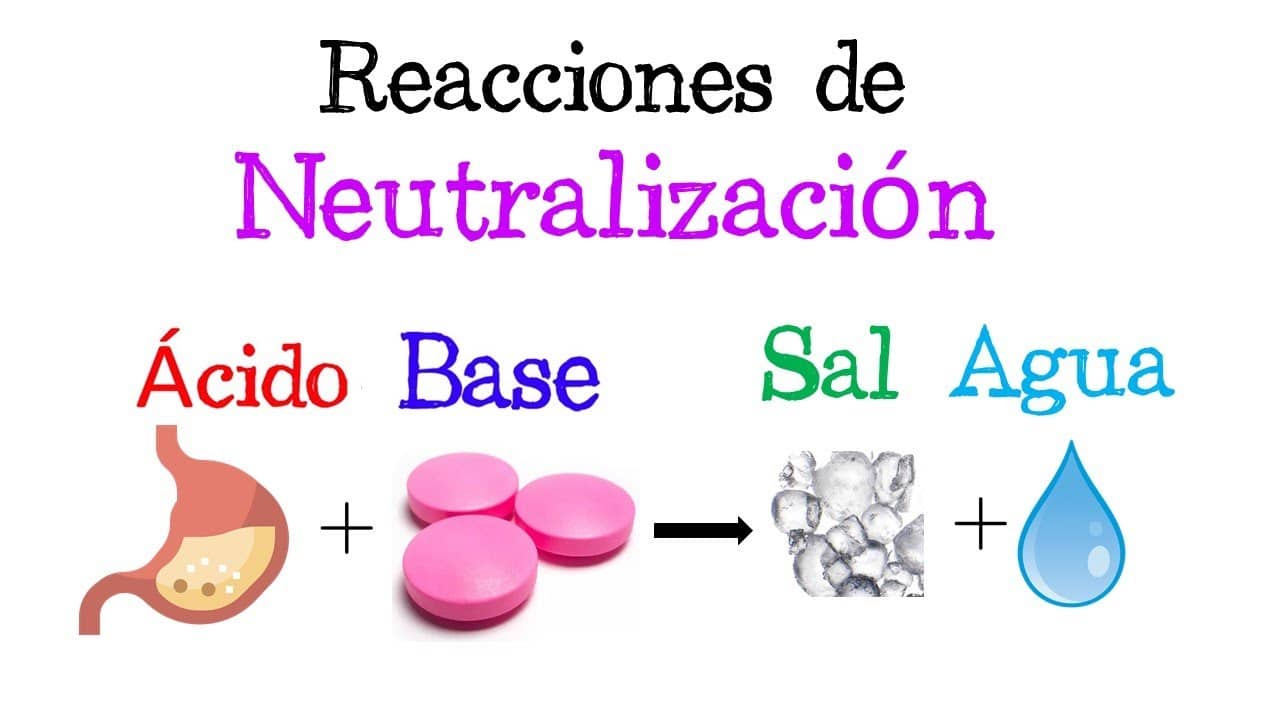
Uno reacción de neutralización se caracteriza por la reacción química entre un ácido (una partícula capaz de ionizarse a sí misma, produciendo al menos un catión hidronio H+) y una base (partícula capaz de disociarse, liberando al menos un anión hidroxilo OH–), dando como resultado un producto de sal y agua.
- IONIZACIÓN: Producción acuosa de iones a partir de un enlace químico de naturaleza covalente, es decir, a partir de un intercambio de electrones.
- DISOCIACIÓN: Liberación de iones a partir de un enlace químico de naturaleza iónica, es decir, de una donación y recepción de electrones.
Considere las tres reacciones de neutralización a continuación, identificadas por A, B y C:
- LA) HCl + NaOH → NaCl + HdosO
- B) 2HCl + Mg (OH)dos → MgCldos + 2HdosO
- C) 3HCl + Al (OH)3 → AlCl3 + 3HdosO
En LA, El ácido clorhídrico reacciona con el hidróxido de sodio para formar cloruro de sodio y agua. En B, este mismo ácido reacciona con hidróxido de magnesio, dando como resultado los productos cloruro de magnesio y agua. Ya estoy en eso C, este ácido reacciona con hidróxido de aluminio, produciendo cloruro de aluminio y agua.
El propósito de este análisis, más que descubrir la concentración de ácido o base, es verificar la proporción de combinación química entre los elementos en las fórmulas moleculares o, más precisamente, el número de enlaces químicos formados por los metales (Na, Mg y Al). Una vez que se dispone de las concentraciones de todas las sustancias implicadas en las neutralizaciones, es posible determinar con precisión las fórmulas antes mencionadas de las sales formadas (NaCl, MgCldos y AlCl3), que sirve como indicador del estado de oxidación de los metales.
Se puede observar entonces que en la primera ecuación, el ácido y la base se encuentran en la misma proporción, formando una sal con un solo cloruro, lo que ocurre porque el sodio es monovalente. En la segunda ecuación, el magnesio metálico es bivalente, por lo que la relación de reacción es de dos moles de ácido por mol de base, lo que da como resultado una sal con dos cloruros. La tercera ecuación presenta un metal trivalente, que da como resultado una relación de reacción de tres moles del ácido a un mol de la base, lo que da como resultado una sal con tres aniones cloruro.
Por tanto, se puede concluir que la relación entre ácido y base también indica la relación entre catión y anión en la molécula de sal producida. Entonces, cuando el ácido y la base están en una proporción de 1: 1, esta también será la proporción de catión y anión en la sal resultante. Cuando la proporción de ácido es mayor, proporcionalmente habrá una mayor proporción de anión en la sal. Cuando la proporción de base es mayor, habrá más cationes que aniones en la sal producida.
Referencias:
SARDELLA, Antonio; MATTHEW, Edegar; Curso de Química: química general, Ed. Ática, São Paulo / SP – 1995.
RUSSELL, John B .; Química general vol.1, São Paulo: Pearson Education of Brazil, Makron Books, 1994.
MAHAN, Bruce M .; MYERS, Rollie J .; Química: un curso universitario, Ed. Edgard Blucher LTDA, São Paulo / SP – 2002.
Exámenes de ingreso y exámenes
Pregunta 01: (UDESC 2017/2)
Cierto medicamento, destinado al tratamiento de los síntomas de la acidez, tiene en su formulación el hidróxido de magnesio en la proporción de 40 mg / mL.
Considerando que la concentración de ácido clorhídrico presente en el estómago es de 0.16 mol / L, marque la alternativa que contiene el volumen aproximado de ácido clorhídrico, el cual será neutralizado, cuando una persona ingiera 5 mL de este medicamento.