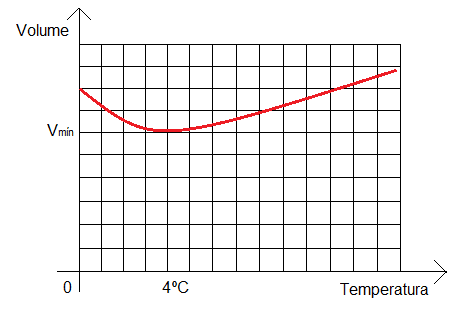
Las sustancias generalmente se hinchan cuando se calientan y se contraen cuando se enfrían. Sin embargo, el agua no tiene este comportamiento. De 4 ºC a 100 ºC, el agua se comporta normalmente como cualquier otra sustancia, aumentando su volumen cuando se calienta, pero de 0ºC a 4ºC, se contrae cuando se calienta, en lugar de expandirse. Ahí está el comportamiento anómalo del agua!
Antes de explicar este comportamiento, revisemos algunos hechos:
- 1) a medida que se calienta el agua, su volumen disminuye (entre 0ºC y 4ºC);
- 2) a medida que se calienta el agua, su volumen aumenta (entre 4ºC y 100ºC);
- 3) entre 4ºC y 100ºC la densidad del agua disminuye a medida que aumenta su volumen (la densidad mínima se da a los 100ºC, cuando el agua comienza a transformarse en vapor);
- 4) entre 0ºC y 4ºC aumenta la densidad del agua, porque su volumen disminuye (la densidad máxima se da a los 4ºC, donde su volumen es el menor posible);
Estos cuatro hechos se pueden ver en el cuadro a continuación:
A 0ºC, tenemos el estado sólido del agua, cuando se convierte en hielo. El volumen debe ser mínimo debido al hecho de que es un sólido (moléculas fuertemente unidas). Pero eso no sucede por puentes de hidrogeno que se forman en el estado sólido del agua. Ocurren a través de un enlace molecular que se origina a partir de la atracción de polos negativos y positivos de diferentes moléculas, generando una geometría en el hielo que requiere un área mayor.
Por lo tanto, con un área más grande (más grande volumen), pero con la misma masa de agua, la densidad tiende a disminuir, lo que hace que el hielo flote en el agua.
Al calentar el agua, hay una mayor agitación de las moléculas, rompiendo los enlaces de hidrógeno. Así, de 0ºC a 4ºC, cuando la temperatura comienza a subir, los puentes comienzan a romperse, pero en lugar de aumentar el volumen de agua, disminuye, debido a la rotura de los puentes, haciendo que el área ocupada por ellos disminuya.
Es decir, en el estado de hielo el volumen fue mayor que entre 0ºC y 4ºC. Cuando la mayoría de los puentes se rompen a 4ºC, el agua tiene su volumen mínimo y, a partir de ese momento, deja de contraerse y tiende a dilatarse con el aumento de temperatura, comenzando el proceso normal igual a todas las sustancias.
Este fenómeno, del hielo de mayor volumen (menor densidad) entre 0ºC y 4ºC, provoca que los lagos mantengan una capa de hielo en la superficie, pero el agua permanece en estado líquido en su interior, permitiendo la vida en el medio acuático. LA convección ayuda a mantener este estado, ya que el agua más densa (con temperatura cercana a los 4ºC) tiende a descender hasta el fondo del lago, mientras que el agua menos densa (cercana a los 0ºC) tiende a subir, ayudando a formar la capa de hielo en la superficie.
Otros ejemplos conocidos por esta característica del agua son los icebergs en la superficie de los océanos y el estallido de una botella de agua congelada en el refrigerador.