La formación de enlaces químicos es un tema importante en química, ya que en la inmensa mayoría de los casos, la naturaleza del enlace químico cambia varias propiedades del compuesto formado. Los compuestos inorgánicos tienen dobles enlaces, caso de dióxido de carbono, COdos, y junto con otros factores altera la geometría molecular de las sustancias.
La presencia de un doble enlace en la molécula adquiere mayor notoriedad e importancia a la hora de estudiar moléculas orgánicas. Es precisamente en estas moléculas donde los efectos de los dobles enlaces son más evidentes.
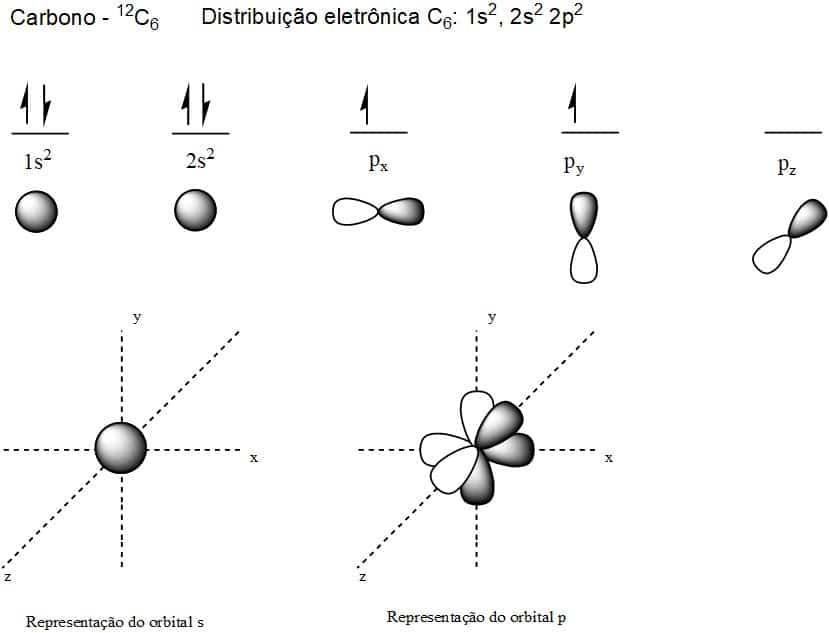
En la siguiente figura tenemos la representación de orbitales de carbono atómicos (sin hibridación).

Posibles orbitales de carbono atómico.
Los enlaces entre átomos de carbono se representan normalmente con el modelo de varillas (H3C – CH3, por ejemplo). Este modelo, sin embargo, no es el más adecuado a la hora de intentar explicar fenómenos inherentes a estos enlaces, como la reactividad de alquenos y alquinos.
La reactividad de estos compuestos se debe a la naturaleza del enlace químico entre los carbonos. En el caso de la molécula de etileno (CdosH4) tenemos dos enlaces entre carbonos, llamados enlace σ (sigma) y enlace π (pi). La siguiente tabla muestra la representación de los enlaces presentes en la molécula de etileno (ya hibridada – spdos):

Modelo de representación orbital de la molécula de etileno.
En la molécula de etileno, el enlace σ (sigma) está formado por la superposición de orbitales atómicos spdos. Este enlace inicial es el más fuerte en comparación con el enlace π (pi). El enlace π, por otro lado, está formado por la aproximación lateral de los orbitales p (en relación con el eje), como se muestra en la figura anterior.
Al ser un enlace formado por orbitales atómicos que se acercan en paralelo, este enlace se vuelve más frágil y puede romperse con menos aporte de energía. La siguiente figura demuestra el aplanamiento de la molécula de etileno, acentuando la proyección perpendicular del orbital «p».

Orbital «p» atómico.
El enlace C – C de tipo π, cuando está en doble enlace, tiene aproximadamente 63 kcal de energía, mientras que el enlace C – C de tipo σ tiene ≈ 83 kcal. Esto justifica una serie de propiedades reactivas que tienen los alquenos, como la capacidad de participar en reacciones de adición, oxidación suave y oxidación energética, por ejemplo. Las reacciones de adición en los alquenos pueden ocurrir por ataque electrofílico o nucleofílico, y se utilizan en el sector productivo a escala industrial. Se producen varios compuestos y la siguiente tabla proporciona un resumen básico de los procesos y productos correspondientes:
| Proceso | Molécula de reactivo / catalizador | Productos |
| Adición de haluro de hidrógeno | Hola, HBr, HCl, HF | haluros orgánicos |
| Adición de halógeno | Idos, brdos, Cldos,Fdos | haluros orgánicos |
| Adición de hidrógeno | Hdos/ Ni o Pt (catalizadores metálicos) | alcanos |
| agregando agua | HdosO | alcoholes |
| oxidación leve | kmnO4 (diluido) | Éteres, dialcoholes (hidrólisis) |
| oxidación de energía | kmnO4 (concentrado)/ HdosSOLO4 | Cetonas, ácidos carboxílicos |
| Ozonólisis | O3 | Aldehído y cetona |
La presencia de dobles enlaces altera cuestiones relacionadas con los ésteres naturales, como grasas y aceites. Las grasas son ácidos grasos con largas cadenas saturadas y tienden a solidificarse a temperatura ambiente, mientras que los aceites, debido a que tienen insaturaciones en sus cadenas, son líquidos a la misma temperatura.
Referencias:
CAMPOS, MM; AMARAL, LFP [et.al]. Fundamentos de Química Orgánica. São Paulo: Edgard Blücher, 1980. p. 75 – 109.
LISBOA, JCF Química, 3er año: bachillerato. 1ª Ed. – São Paulo: Ediciones SM, 2010. (Colección Ser protagonista). p.58 – 59.