LA electronegatividad y el electropositividad son dos propiedades periódicas que indican la tendencia de un átomo, en un enlace químico, a atraer electrones compartidos. O pueden representar la fuerza con la que el núcleo atrae la electrosfera.
Se definen de la siguiente manera:
electronegatividad es la tendencia de un átomo a atraer electrones compartidos en un enlace químico; de lo contrario, el electropositividad indica la tendencia del átomo a liberar estos electrones cuando se une a otro.
Los gases nobles son elementos cuyos valores de electronegatividad y electropositividad son los más bajos posibles. Porque, dado que tienen estabilidad electrónica, no tienen una tendencia significativa a perder o ganar electrones.
En un enlace químico, la diferencia de electronegatividad indica el carácter del enlace: en teoría, si la diferencia de electronegatividad entre dos átomos unidos entre sí es mayor que 1,7 eV, se caracteriza como iónico.
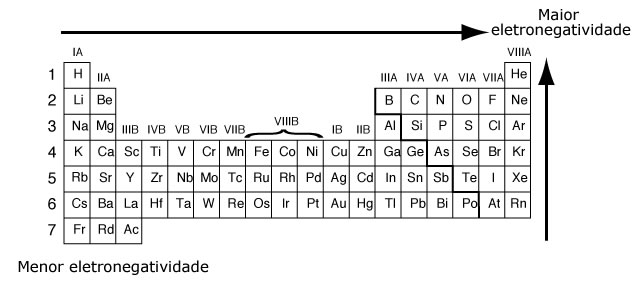
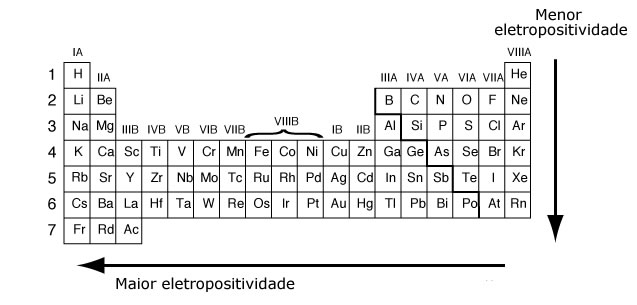
Estas dos propiedades crecen en la tabla periódica de formas exactamente opuestas: mientras que la electronegatividad crece de abajo hacia arriba en los grupos (familia) y de izquierda a derecha en los períodos; la electropositividad crece de arriba a abajo en grupos y de derecha a izquierda en períodos:
La electronegatividad podría determinarse numéricamente mediante la ecuación propuesta por Linus Pauling: Y= 0,184 (I+LA).
Donde, I = potencial de ionización y A = afinidad electrónica.
A partir de esta expresión, se definió la electronegatividad de todos los elementos de la tabla (esquemáticamente, con la excepción de los gases nobles). El flúor (F) es el átomo más electronegativo.
Variación de electronegatividad y electropositividad
La electronegatividad y la electropositividad son más altas o más bajas en los átomos de los elementos de la tabla y se correlacionan con otras propiedades periódicas:
- Radio atómico: cuanto menor es el radio atómico, mayor es la fuerza con la que el núcleo atrae la electrosfera. Así, cuanto mayor es la electronegatividad y menor es la electropositividad del átomo;
- Afinidad electrónica: como la afinidad electrónica mide la tendencia de un átomo a recibir un electrón en su electrosfera, cuanto mayor es esta propiedad, mayor es la electronegatividad. A diferencia de la electropositividad, que se vuelve más pequeña.
- Potencial de ionización (o energía): Como la energía de ionización indica la tendencia del átomo a convertirse en un ion positivo con valencia +1 (es decir, perder un electrón), cuanto mayor sea su valor, mayor será la electronegatividad y menor la electropositividad del átomo.