Las primeras teorías de cómo los átomos se unen para formar nuevas sustancias químicas fueron presentadas por el científico suizo Torbern Olof Bergman (1735-1784) y más tarde por el químico francés Marcelin Berthellot (1827-1907), basadas en la atracción de las masas de átomos y por su atracción gravitacional.
Con la evolución de los estudios cuánticos se encontró que esto no es lo que sucede en la práctica, los átomos tienden a buscar la estabilidad según la teoría del octeto, por eso realizan enlaces químicos, en busca de la estabilidad química.
Los cationes son átomos que tienen una carga iónica positiva y tienden a donar electrones que buscan estabilizarse, mientras que los aniones son átomos con una carga iónica negativa y que tienen tendencia a recibir electrones en busca de estabilidad.
A enlaces iónicos ocurren por atracción electrostática entre cationes y aniones, y este enlace ocurre cuando un electrón de la capa de valencia de un átomo con carga iónica negativa se transfiere a la capa de valencia de un átomo con carga iónica positiva. Los compuestos iónicos no están formados por moléculas, sino por iones que son atraídos electrónicamente, formando pares iónicos que generan redes cristalinas. Estas redes pueden ser diferentes según los átomos que las constituyen.
Para comprender mejor cómo funciona esta atracción entre iones, usemos el compuesto cloruro de sodio (NaCl) o sal de mesa. El átomo de cloro atrae el electrón de valencia del sodio por su electronegatividad, haciendo que el cloro sea el anión y el sodio el catión, formando un compuesto iónico.
Compuesto en medio acuoso: Na(s) + Cl(gramo) → En+(aquí) + Cl–(aquí)
Compuesto sólido: Na(s) + ½ Cl2 (g) → NaCl(s)
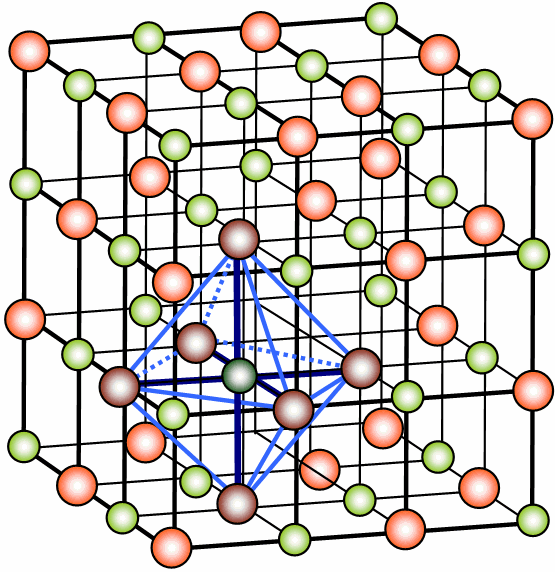
La red cristalina se forma mediante la organización de los átomos que forman el compuesto iónico. A continuación tenemos imágenes que representan un retículo cristalino y su disociación en un medio acuoso:

Rejilla cristalina de NaCl. Ilustración: H. Hoffmeister / vía Wikimedia Commons / CC-BY-SA 3.0

Disociación de cloruro de sodio en medio acuoso. Ilustración: OpenStax College / vía Wikimedia Commons / CC-BY-SA 3.0 [adaptado]
Ahora veamos algunas propiedades comunes de los compuestos iónicos:
Existe una amplia gama de compuestos iónicos que se pueden formar, por ejemplo:
- Calcita: Carbonato de calcio (CaCO3) – Mineral utilizado en la construcción civil;
- Hematita: Óxido de hierro III (Fy2O3) – Se utiliza en la obtención de hierro, fabricación de pigmentos, clavos, tornillos, etc .;
- Nitrato de sodio (NaNO3) – Utilizados en la fabricación de fertilizantes y explosivos.
- Carbonato de calcio (CaCO3) – Se encuentra en cuevas, en la formación de estalactitas y estalagmitas y como materia prima para la fabricación de cemento, acero y vidrio.
- Cloruro de cesio (CsCl): se utiliza en aplicaciones de fabricación de cerveza, agua mineral y medicina nuclear.
Referencias:
BIANCHI, JC de A. Universo de Química: Bachillerato: Volumen único. 1. Ed. São Paulo: FTD, 2005.
SANTOS, WLPdos .; MOL, G. de S. Citizen Chemistry: Volumen 1: Bachillerato. 2. ed. São Paulo: AJS, 2013.
FONSECA, MRM da. Química 1. 1. ed. São Paulo: Ática, 2013.