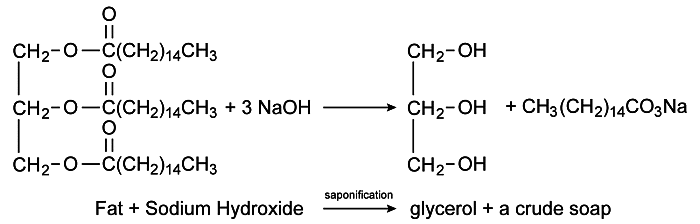
También llamado hidrólisis alcalina, a reacción de saponificación es un tipo de reacción química que tiene lugar entre un éster y una base inorgánica o una sal básica, teniendo como productos finales una sal orgánica y un alcohol.
El nombre saponificación se debe a que cuando se utiliza un éster derivado de un ácido graso en reacciones de este tipo, se produce jabón, y dado que la principal fuente natural de ácidos grasos son las grasas y los aceites, su hidrólisis alcalina son los principales procesos aplicado a la producción de sales de ácidos grasos, conocidas popularmente como jabones. Brevemente, tenemos:
Aceite o grasa + base fuerte -> jabón + glicerol
Las bases más utilizadas en las reacciones de saponificación son el hidróxido de sodio (NaOH), que produce un jabón más consistente, o el hidróxido de potasio (KOH), que da lugar a un jabón más suave, conocido como jabones de potasio. En Brasil, la producción de jabón casero sigue siendo frecuente, utilizando agua con cenizas (lejía) en lugar de hidróxidos de potasio o sodio. El agua de ceniza tiene un carácter alcalino debido al carbonato de potasio que la compone, que en solución acuosa libera iones OH–.
Otro producto de la reacción de saponificación es el glicerol, un compuesto orgánico que forma parte del grupo de los alcoholes. Debido a esto, las industrias del jabón también producen glicerina, una forma comercial de glicerol con un 95% de pureza. Esta sustancia tiene propiedades hidratantes, es decir, es capaz de mantener la humedad, por lo que se aplica a la producción de cremas y lociones para la piel, jabones y productos alimenticios.
Debido a su acción detergente (del latín desintoxicar, limpio), los jabones son muy útiles en los procesos de limpieza, especialmente para eliminar la grasa. Esta característica se explica por la estructura del jabón: su molécula tiene un lado polar que interactúa con el agua, y un lado no polar, que interactúa con la grasa, formando así partículas que quedan dispersas en el agua y son arrastradas durante el lavado.
Referencias:
http://pt.wikipedia.org/wiki/Saponification
http://quimicasemsegredos.com/reacao-de-Saponificacao.php
http://processo-industrial.blogspot.com/2010/05/saponificacao-sabao.html