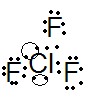LA teoría o Método VSEPR fue formulado en 1957 por el científico Ron Gillespie, con la intención de ser utilizado como herramienta para predecir la geometría de las moléculas, es decir, la forma en que la molécula está ordenada en el espacio. el acrónimo en inglés VSEPR (pronunciado víspera) medio Repulsión del par de electrones de la capa de valencia o repulsión electrónica entre pares de electrones en la capa de valencia, también aparece en algunos libros de texto como REPECV. Esta teoría se centra principalmente en lo que dice su nombre. En relación a la distancia máxima que deben mantener los pares solitarios en la organización de la nube de electrones alrededor del átomo central. Según los pasos que se muestran a continuación, es más fácil hacer esta predicción:
Pasos para determinar la forma de una molécula en el espacio:
- Observe y dibuje la estructura de Lewis para la molécula;
- Cuente el número de pares de electrones unidos y aislados presentes en la molécula y determine la número esterico (suma de todos los pares solitarios y enlazados).
- Haz un arreglo colocando los pares de electrones en los vértices de una figura geométrica, para reducir tanto como sea posible la repulsión entre los pares solitarios.
Primero usemos como ejemplo la molécula de trifluoruro de cloro ClF3.

Al observar esta figura, se concluye que, mostrando el número estérico 5, la molécula tendrá una geometría denominada Bipiramidal Trigonal según la tabla siguiente, y por tener 2 pares solitarios, se clasificará en la forma de subcategoría de T, porque esta disposición es la que confiere una repulsión mínima entre los pares de electrones.
Es importante señalar que la Teoría VSEPR es eficiente en la predicción de pequeñas moléculas poliatómicas e iones, una de las observaciones más importantes es prestar especial atención a los pares solitarios ya que ejercen las fuerzas que influyen en los enlaces químicos, ya que el objetivo principal de esta teoría es la determinación de formas moleculares que son de suma importancia para la química con respecto a los puntos de fusión y ebullición, la energía de enlace y la solubilidad.
Bibliografía:
Russell, JB Química General. São Paulo: Makron Books, 2004.
Vogel, Arthur Israel, 1905-Química analítica cualitativa / Arthur I. Vogel; [tradução por Antonio Gimeno da] 5. ed. Rvdo. de G. Svehla.- São Paulo: Mestre Jou, 1981.
Mahan, BM Química: un curso universitario. 4ª ed. São Paulo: Edgard Blücher, 2003.
SHRIVER, DUWARD; ATKINS, PETER. Química inorgánica – 4ª edición. Porto Alegre, Bookman, 2008.
LEE, JD. La química inorgánica no es tan concisa – traducción de la cuarta edición en inglés. São Paulo, Edgard Blücher, 1996.
James Brady, Humiston Gerard E. QUÍMICA GENERAL – 2ª EDICIÓN