Tabla de contenidos
La afinidad electrónica o electroafinidad es un propiedad periódica que indica la cantidad de energía liberada cuando un átomo recibe un electrón.. Este átomo está solo y en estado gaseoso.
Este átomo, que es inestable, gana estabilidad cuando recibe el electrón. De ahí provienen los enlaces químicos, según la teoría del octeto.
Un átomo que tiene una capa con 2 electrones y uno con 5 electrones tiende a obtener un electrón más. Esto sucede para que se formen pares en esta segunda capa que, de esta forma, traen estabilización al átomo.
Afinidad electrónica en la tabla periódica
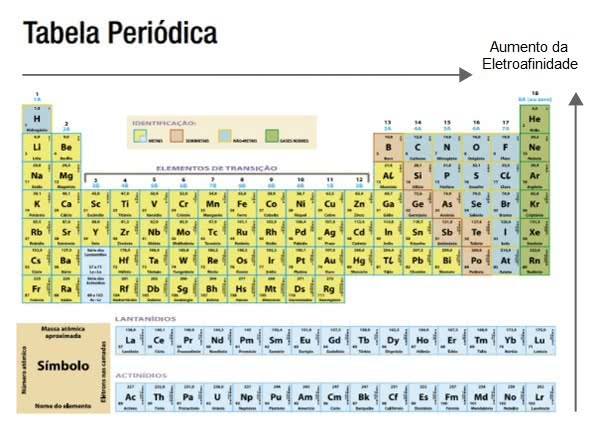
La afinidad electrónica es mayor en los elementos enumerados en el lado derecho y en la parte superior de la tabla periódica.
Crece horizontalmente de izquierda a derecha y verticalmente de abajo hacia arriba.
Tenga en cuenta que la electroafinidad es inversa al radio atómico. Se hace más grande a medida que el radio atómico se hace más pequeño.
El cloro tiene una gran afinidad electrónica. Esto se debe a que tiene un radio pequeño, lo que proporciona la atracción del electrón.
La afinidad electrónica del cloro es 349 KJ / mol.
En lo que respecta a la afinidad electrónica de los gases nobles, es irrelevante. Esto se debe a que no pueden recibir electrones y, por lo tanto, no liberan energía.
Cuanto más estable es un átomo, más energía libera. Al mismo tiempo, cuanto más negativa es esta afinidad, más electrones son atraídos por los átomos.
Por el contrario, la afinidad positiva ocurre cuando el radio atómico es mayor y esta atracción se reduce. Es la electropositividad, también conocida como carácter metálico. Eso es porque los metales son elementos altamente positivos.
Energía de ionización y afinidad electrónica
Tanto la afinidad electrónica como la energía de ionización son propiedades periódicas. Ambas son fuerzas que influyen en los átomos, pero de diferentes formas.
La afinidad electrónica indica la cantidad de energía liberada cuando un átomo recibe un electrón.
La energía de ionización, a su vez, determina la cantidad de energía necesaria para eliminar un electrón del átomo.
¿Y electronegatividad?
La electronegatividad es otra propiedad periódica. Indica la atracción de los átomos a los electrones.
En breve:
- afinidad electrónica – energía liberada con la recepción de un electrón por un átomo.
- Energía de ionización – energía necesaria para eliminar un electrón de un átomo.
- electronegatividad – atracción de átomos por electrones.
Lea también: