Los carbohidratos se caracterizan por ser, junto con las proteínas y los lípidos, uno de los mayores constituyentes orgánicos de casi todos los tejidos vivos, tanto vegetales como animales. Están destinados principalmente a ser una fuente de energía para todos los organismos en los que se encuentran, y en muchos son también los principales componentes de apoyo. Con respecto a las verduras, los carbohidratos destacan por ser los compuestos que se encuentran en mayor cantidad.
Diariamente llamados carbohidratos de azúcar, o todavía los conocemos como carbohidratos o carbohidratos. En su estructura química predominan las funciones orgánicas aldehído y cetona.
Los siguientes experimentos tienen como objetivo probar la solubilidad en agua de algunos carbohidratos e identificar aquellos que tienen propiedades reductoras de aquellos que no las tienen, a través de La reacción de Benedict.
Concepto: Los carbohidratos son derivados de aldehídos o cetonas de alcoholes polihídricos. Comprenden otros aldehídos o alcoholes cetónicos (sus anhídridos o polímeros).
La) Solubilidad: Los glicidos son compuestos de alta polaridad, lo que favorece su solubilidad en agua, ya que este disolvente también es polar.
- Tome tres tubos de ensayo y ponga una pizca de glucosa sólida (glicida) en cada uno.
- En el tubo 1 agregue 2ml de agua destilada.
- En el tubo 2 agregue 2 mL de alcohol etílico.
- En el tubo 3 agregue 3ml de acetona.
- Agite los tubos y observe la solubilidad.
B) La reacción de Benedict: diferenciación entre carbohidratos reductores y no reductores.
- Prepare 5 tubos de ensayo, márquelos y pipetee en cada uno 3 ml de reactivo de Benedict.
- Añadir: en el tubo 1: 5 gotas de glucosa al 1%; en el tubo 2: 5 gotas de sacarosa al 1%; en el tubo 3: 5 gotas de maltosa al 1%; en el tubo 4: 5 gotas de almidón al 1% y en el tubo 5: 5 gotas de agua (se usa para probar el reactivo de Benedict, es decir, es el tubo de control).
- Mezclar bien y calentar durante tres minutos al baño maría hirviendo.
- Observe el color y la posible formación de un precipitado.
Explicación:
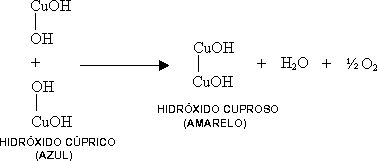
En el reactivo de Benedict hay una pequeña cantidad de hidróxido cúprico con cuprocitrato de sodio, una sal compleja soluble en agua.
Bajo la acción del calor y el álcali, el azúcar reductor se descompone parcialmente en fragmentos oxidables por el hidróxido cúprico. En esta reacción, el hidróxido cúprico (azul) se reduce a hidróxido cuproso (amarillo).
Continuando con el calentamiento, el hidróxido cuproso pierde una molécula de agua y se convierte en óxido cuproso (rojo).
Referencias:
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; La química en el enfoque de la vida cotidiana, Ed. Moderna, vol.1, São Paulo / SP-1998.
SARDELLA, Antonio; MATTHEW, Edegar; Curso de Química: química general, Ed. Ática, São Paulo / SP – 1995.
MAHAN, Bruce M .; MYERS, Rollie J .; Química: un curso universitario, Ed. Edgard Blucher LTDA, São Paulo / SP – 2002.