Tabla de contenidos
El tema de solución, generalmente parte del plan de estudios del segundo año de la escuela secundaria brasileña, aborda un capítulo de fundamental importancia para el estudiante, ya que cubre aspectos teóricos, de laboratorio y cálculos químicos. Así, este texto presenta una introducción teórica a la asignatura, que tiene como objetivo facilitar su presentación a los alumnos, tanto en la escuela como en el laboratorio de química.
Definición
Las soluciones son mezclas homogéneas que tienen una sola fase. Por ejemplo, una cierta masa de cloruro de sodio, cuando se diluye completamente en un cierto volumen de agua, forma una solución.
Componentes
Una verdadera solución consta de al menos dos componentes:
- SOLUTO: es aquel que está presente en menor proporción, en masa.
- DISOLVENTE: es el que está presente en mayor proporción, en masa.
La mezcla homogénea entre soluto y solvente se llama solución. No todas las soluciones presentarán agua como disolvente, como se muestra a continuación:
- Mezclando 1 g de cloruro de sodio (NaCl) en 1 litro de HdosO, tendremos una solución, en la que NaCl es el soluto y el agua es el solvente.
- El alcohol comercial comprado en los supermercados es una mezcla homogénea de alcohol y agua, que generalmente consta de un 92% de alcohol y un 8% de agua. En este caso, el alcohol es el solvente y el agua es el soluto.
Calificaciones
Una solución se puede clasificar en función de varias de sus propiedades, siendo de suma importancia las siguientes clasificaciones:
- En cuanto al estado físico: Podemos tener una solución en cualquier estado físico de la materia, así:
- Soluciones sólidas: reciben el nombre de aleaciones, y generalmente son una mezcla homogénea entre metales, por ejemplo, el oro de 18 quilates es una mezcla formada por oro, cobre y plata. El bronce es una mezcla de zinc y estaño.
- Soluciones liquidas: puede ser de tres naturalezas diferentes:
- Sólidos disueltos en líquidos: por ejemplo, el agua de mar es una solución que tiene varios solutos, entre ellos cloruro de sodio, cloruro de magnesio (MgCldos) y bicarbonatos (HCO3–).
- líquidos disueltos en líquidos: por ejemplo, tenemos el combustible llamado gasolina, que es una mezcla de hidrocarburos derivados del petróleo y alcohol, en una proporción aproximada de 80% a 20%.
- Gases disueltos en líquidos: por ejemplo, en un acuario hay que diluir el oxígeno gaseoso (Odos) en el agua, siendo este gas el responsable de la respiración de los peces. Por lo tanto, si el acuario no permanece abierto, es necesario inyectar regularmente este gas a través de un cilindro.
- Soluciones de gas: son los que constan únicamente de gases, y toda mezcla entre gases tiene una sola fase, por lo que es una solución. Por ejemplo, el aire atmosférico es una mezcla que consta de un 78% de nitrógeno gaseoso (Ndos), 21% de oxígeno gaseoso y 1% de otros gases.
- En cuanto a la naturaleza de las partículas dispersas: Según la naturaleza del soluto, podemos tener dos tipos de soluciones:
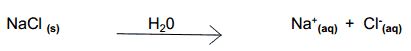
- Soluciones iónicas: son los que tienen iones disueltos. También se denominan soluciones electrolíticas, ya que conducen corriente eléctrica. Por ejemplo, al diluir 1g de sal de mesa (NaCl) en agua, tendremos una solución que tiene iones de Na.+ y Cl– disuelto, de acuerdo con el esquema siguiente:
- Soluciones moleculares: son los formados por moléculas disueltas. También se denominan no electrolíticos, ya que no conducen corriente eléctrica. Por ejemplo, cuando repetimos el procedimiento anterior, pero esta vez usando azúcar (C12H22O11) en lugar de sal, notaremos (según la siguiente ecuación) que no hay separación del soluto, por lo tanto, es una solución constituida por moléculas disueltas, moleculares.
- Soluciones iónicas: son los que tienen iones disueltos. También se denominan soluciones electrolíticas, ya que conducen corriente eléctrica. Por ejemplo, al diluir 1g de sal de mesa (NaCl) en agua, tendremos una solución que tiene iones de Na.+ y Cl– disuelto, de acuerdo con el esquema siguiente:
- En cuanto a la relación entre soluto y disolvente: De acuerdo con las cantidades de masa de soluto y solvente presentes en la solución, podemos tener cuatro clasificaciones posibles. Para entenderlos, necesitamos conocer el concepto de coeficiente de solubilidad (CS). CS representa la cantidad máxima de un soluto dado que podemos disolver en 100 g de agua a temperatura ambiente. Por lo tanto, establezca que CS NaCl = 37g / 100g de HdosO, significa que por cada 100g de agua podremos disolver a temperatura ambiente un máximo de 37g de NaCl. Ahora podremos comprender las clasificaciones más simples posibles para una solución en términos de la relación de soluto a solvente.
- Soluciones diluidas: son aquellos que tienen una pequeña cantidad de soluto en relación a la cantidad de solvente. Por ejemplo, una solución formada por 1 g de NaCl por 100 g de agua.
- soluciones concentradas: son aquellos que tienen una gran cantidad de soluto en relación al solvente. Por ejemplo, una solución formada por 30 g de NaCl en 100 g de agua;
- Soluciones saturadas: son los formados por el soluto máximo permitido, en relación a su coeficiente de solubilidad. Por ejemplo, una solución que consta de 37 g de NaCl en 100 g de HdosO.
Referencias:
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; La química en el enfoque de la vida cotidiana, Ed. Moderna, vol.1, São Paulo / SP-1998.
MAHAN, Bruce M .; MYERS, Rollie J .; Química: un curso universitario, Ed. Edgard Blucher LTDA, São Paulo / SP – 2002.