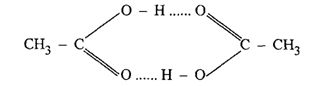LA enlace de hidrógeno, muchas veces equivocado denominado enlace de hidrógeno, es uno de los tipos de interacción intermolecular (los otros son ión-dipolo, dipolo-dipolo y fuerzas de London), por lo que no puede considerarse un enlace covalente, lo que da cierta estabilidad en enlaces con alta electronegatividad. átomos.
A menudo, los líquidos con altos puntos de fusión se pueden observar precisamente porque tienen interacciones de tipo enlace de hidrógeno que requieren mucha energía para romperse. A veces, incluso cuando un líquido está completamente hervido, varios de estos enlaces pueden permanecer en la fase de vapor: en una masa determinada de ácido acético, por ejemplo, coexisten varios dímeros con la forma H.3CCOOH:
Como puede verse en el esquema anterior, el grupo OH de una molécula de ácido acético se une al átomo de oxígeno de la otra. Formando así el enlace de hidrógeno.
Aspectos de los enlaces de hidrógeno
El hidrógeno solo puede formar este tipo de enlace con otro átomo si y solo si su carga parcial es positiva. Por tanto, puede aceptar un par electrónico (coordinado covalentemente).
En el caso del ácido acético, tomando el hidrógeno del grupo OH, se puede ver que el par de electrones compartidos está más cerca del átomo de oxígeno (más electronegativo). Por tanto, el hidrógeno tiene, en este enlace, una carga parcial positiva. Y, aún así, al ser un átomo pequeño, puede ser atraído por uno de los pares electrónicos aislados de un átomo de oxígeno (que tiene 3) de otra molécula.
De ahí una interacción extremadamente fuerte provocada por la carga parcial positiva del hidrógeno con este par electrónico aislado: el propio enlace de hidrógeno.
Las interacciones de hidrógeno también ocurren en el agua:
Que el enlace de hidrógeno se produzca entre átomos de alta electronegatividad es indiscutible. Lo que a menudo puede escapar a la literatura es considerar solo nitrógeno, flúor y oxígeno como los átomos potenciales para tal interacción. Bueno, hay otros átomos que también son muy electronegativos (como el cloro) que pueden experimentar este fenómeno. Por lo tanto, no es justo limitar el universo de posibilidades solo al grupo N, F, O.
Los verdaderos puentes de hidrógeno
Los enlaces de hidrógeno no son sinónimos de enlaces de hidrógeno, porque, incluso si tienen una especie en común, son situaciones completamente diferentes: los enlaces de hidrógeno representan una disposición molecular que consta de 2 electrones divididos entre 3 átomos (3 centros, 2 electrones):
En diborana (BdosH6), por ejemplo, dos átomos de boro están unidos por la presencia de átomos de hidrógeno que, literalmente, forman un puente entre ellos. Por lo tanto, la especie BH3 no se evidencia, sino su dímero.
En este ejemplo, 2 electrones de hidrógeno de cada puente se dividen en 2 átomos de boro (por lo tanto, 2 electrones y 3 átomos, BHB).
Fuentes:
ATKINS, Peter. LORETTA, Jones. Principios de la química: cuestionar la vida moderna y el medio ambiente; Ricardo Bicca traducción de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
http://sec.sbq.org.br/cd29ra/resumos/T1907-1.pdf