Cuando dos o más fases de una sustancia están en contacto, ocurre naturalmente una transferencia de masa entre las fases. Esta transferencia se produce de forma espontánea hasta cierto punto en el que ya no es posible verificar ningún cambio en las fases del sistema. Cuando esto sucede decimos que tenemos un equilibrio de fase, donde el potencial químico es igual en todos los sistemas.
Un ejemplo simple de fases en equilibrio es un recipiente cerrado de agua. Inicialmente, la evaporación hará que el agua pase de la fase líquida a la fase gaseosa, pero en un momento dado la tasa de evaporación será igual a la tasa de condensación y pronto tendremos un equilibrio de fases. Al vapor de una sustancia en equilibrio con su fase condensada lo llamamos presión parcial de la sustancia presión de vapor.
Se puede usar agua para un segundo ejemplo de equilibrio de fases. A cero grados tenemos hielo y agua coexistiendo en el mismo sistema, a medida que suministramos calor, el hielo se convertirá en agua, pero el sistema permanecerá en cero grados. Cuando se consume todo el hielo, el suministro de calor aumentará la temperatura del agua. Este comportamiento es típico de las sustancias puras.
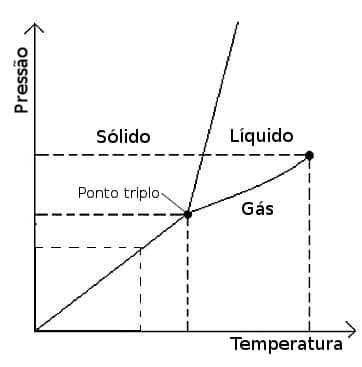
Aunque los equilibrios de fase más habituales son los que involucran dos fases, como se ejemplificó anteriormente, cada sustancia tiene una determinada condición de temperatura y presión donde las tres fases, sólida, líquida y gaseosa se pueden verificar al mismo tiempo, en este punto damos el triple nombre del punto. El ciclohexano, por ejemplo, tiene su punto triple alrededor de una temperatura de 6 ºC y una presión de 5 kPa.

Diagrama de fases de cualquier sustancia pura.
Una forma gráfica de visualizar la relación de las fases de una sustancia se llama diagrama de fases. Un diagrama de fases relaciona la presión y la temperatura con la fase de la sustancia en esas condiciones. Las líneas en el diagrama que divide las fases indican condiciones donde se pueden observar ambas fases, si tres líneas se cruzan tenemos un punto triple. También hay un punto crítico donde se pierde la distinción entre la fase líquida y gaseosa.
Las alteraciones en el equilibrio de fases en general son fáciles de predecir. El aumento de temperatura, por ejemplo, hace que la sustancia tienda al estado con menos agregación, líquido o gaseoso. Por otro lado, un aumento de presión hace que la sustancia prefiera permanecer en la fase con menor densidad, en general esto significa fase sólida, pero esto no es cierto para todas las sustancias. El agua, por ejemplo, es más densa en la fase líquida, por lo que el hielo flota en el agua, por lo que cuando presionamos un cubo de hielo tiende a derretirse.