LA termoquímica es la rama de la química que estudia las reacciones a través de la cantidad de energía liberada o absorbida durante el proceso de reacción. Para saber si un sistema pierde o gana energía, usamos la variación de entalpía, representada por ∆H, como referencia.
El cambio de entalpía se define como la energía en kJ liberada o absorbida cuando el número de moles de reactivos indicado por la ecuación balanceada describe la reacción completa. La variación de entalpía se calcula de la siguiente manera:
∆Productos H = H – Reactivos H
Cuando el cambio de entalpía tiene un valor positivo, decimos que la reacción es exotérmica y cuando el cambio de entalpía es un valor negativo, la reacción es endotérmica.
Una reacción endotérmica es una reacción que recibe calor del entorno circundante. Este tipo de reacción ocurre cuando la energía producida al formar enlaces es mayor que la energía necesaria para romperlos, de donde se libera el exceso de calor de esta reacción al ambiente. Algunos ejemplos de este tipo de reacción son: todas las reacciones de combustión, por ejemplo, quema de combustible.
Una reacción exotérmica es una reacción que libera energía, en forma de calor, al medio ambiente. Ocurre cuando el calor producido formando los enlaces es menor que la cantidad necesaria para romperlos, por lo que el sistema necesita absorber energía del ambiente para compensar esta deficiencia. Algunos ejemplos de reacciones endotérmicas son: agua hirviendo y fotosíntesis.
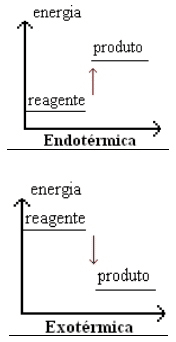
También podemos representar gráficamente este tipo de reacción, como se muestra a continuación:
En las reacciones endotérmicas, la energía comienza baja y aumenta a medida que avanza la reacción.
En las reacciones exotérmicas ocurre lo contrario, es decir, la energía comienza alta y termina siendo liberada al ambiente, terminando más baja.
Algunos conceptos importantes relacionados con la termoquímica son:
Entalpía de formación o calor de reacción: es la energía de la reacción cuando forma 1 mol de sustancia a partir de sustancias químicas (elemento en su estado estándar). El estado estándar es la forma más estable de una sustancia a 25 ° C y 1 atm de presión. Las sustancias que participan en la reacción de formación deben ser simples, es decir, formadas por un solo elemento químico. La entalpía de formación predeterminada para una sustancia simple es cero.
Ejemplo de cálculo a partir de la entalpía de formación: ¿Cuál es el valor de la entalpía de combustión del benceno (C6H6)? Sabiendo que C6H6= + 80 kJ / mol; COdos = -400 kJ / mol; HdosO = -240 kJ / mol
C6H6 + 15/2 Odos → 6COdos + 3HdosO
∆H peine = Hp – Hr
∆H peine = [6x(-400) +3x (-240)] – [ +80 + (15/2 x 0)]
∆H peine = -3200 kJ / mol
Entalpía de combustión: Durante las reacciones químicas, los enlaces químicos cambian. Podemos calcular ΔH analizando estos enlaces recién formados. La entalpía de unión es la variación de entalpía que se encuentra en la ruptura de 1 mol de un enlace químico dado, con todas las sustancias en estado gaseoso, a 25 ° C y 1 atm.
Ejemplo: Calcule la entalpía a partir de las energías de enlace. Sabiendo que HH = + 436kJ; Cl-Cl = + 242 kJ; H-Cl = -431 kJ
Hdos + Cldos → 2HCl
(HH) + (Cl-Cl) 2. (H-Cl)
+ 436 +242 2. (- 431)
+678 kJ absorbidos -862 kJ liberados
∆H = -184 kJ (reacción exotérmica)





En este texto que publican: «Cuando el cambio de entalpía tiene un valor positivo, decimos que la reacción es exotérmica y cuando el cambio de entalpía es un valor negativo, la reacción es endotérmica» hay un error, cuando la variación de la entalpía es negativa la reacción es exotérmica y cuando la variación de la entalpía es positiva la reacción es endotérmica.
∆H>0 Reacción endotérmica
∆H<0 Reacción exotérmica
POR FAVOR CORREGIR