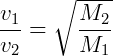El proceso de difusión fraccionada se utiliza como método para separar isótopos por difusión mediante el uso de paredes porosas. En este proceso, el isótopo más pesado se difunde más lentamente. Dependiendo de la diferencia de masa entre los isótopos, la separación se realiza en mayor o menor número de etapas. LOS Ley de Graham, que regula y caracteriza el fenómeno, dice que “La tasa de efusión de los gases es inversamente proporcional a las raíces cuadradas de sus pesos moleculares.«1, de acuerdo con la siguiente ecuación, en la que V representa la velocidad del gas y METRO su peso molecular.
«Thomas Graham fue un químico británico que estudió la efusión de gas y creó la ley que la explica.«dos. Esta ley química se cumple cuando los gases se someten a la misma presión y temperatura. Así, cuanto más ligera sea la sustancia en relación a la otra, más fácil será separarla, ya que la diferencia porcentual de sus masas tiende a ser mayor.
En este sentido, los términos difusión y efusión merecen ser destacados, ya que no pueden utilizarse como sinónimos.
DIFUSIÓN: Fenómeno por el cual dos líquidos o dos gases se mezclan espontáneamente debido a la cinética de sus moléculas o átomos.
EFUSIÓN: Fuga de un gas a través de una pequeña abertura, orificio o poro.
En el laboratorio, la Ley de Graham se puede confirmar mediante la reacción química en fase gaseosa entre los gases de ácido clorhídrico (HCl) y amoniaco (NH)3), de acuerdo con los pasos a continuación:
1. Tome un tubo delgado e incoloro el mayor tiempo posible.
dos. Cierre ambos extremos con hisopos de algodón.
3. Al mismo tiempo, deje caer HCl en un extremo e hidróxido de amonio (NH4OH) en el otro, ambos de concentración 1 molar, y esta base liberará el NH3 gaseoso. Como estas dos sustancias son volátiles, los vapores de HCl y NH3 se difundirá a través del interior del tubo y reaccionará en el punto de contacto, formando una neblina blanca de NH4Cl, según la siguiente ecuación:
HCl(gramo) + NH3 (g) → NH4Cl(s)
4. Tenga en cuenta las distancias cubiertas por los gases.
5. Repita el procedimiento dos veces más, trabajando con valores medios.
6. Si es necesario, repita el experimento una segunda vez, duplicando las concentraciones de reactivo, o una tercera vez, trabajando con reactivos concentrados.
Luego se verificará que esta niebla estará más cerca del final donde se goteó HCl (de mayor peso molecular) que del final que contiene NH3 (de menor peso molecular).
En el experimento descrito, se debe trabajar con el equipo de protección personal (EPP) adecuado y bajo un sistema de escape químico (campana), ya que los dos reactivos utilizados tienen alta toxicidad.
Referencias:
1. http://www2.fc.unesp.br/lvq/exp04.htm
2. http://www.colegioweb.com.br/quimica/difusao-e-efusao-gasosa.html