La termoquímica es la rama de la química que se ocupa del intercambio de calor entre dos sistemas. Una reacción química representa un cambio en la estructura de la materia, siendo un proceso donde los reactivos son químicamente distintos de los productos que se forman. A continuación se discuten 5 temas relacionados con este tema, los cuales son independientes entre sí.
1. Teniendo en cuenta los datos presentados en la siguiente tabla,
| REACTIVO / PRODUCTO | ∆H (condiciones estándar) | |
| 1 | C (gr) → C (d) | +0,5 kcal / mol de C |
| dos | I (g) → 1 / 2I2 (g) | -25 kcal / mol de I |
| 3 | 1 / 2Cl2 (g) → Cl (g) | +30 kcal / mol de Cl |
se puede decir que el reactivo tiene mayor energía que el producto solo en (2), ya que se trata de un proceso exotérmico. En (1) y (3) hay absorción de energía, por lo tanto, los productos tienen mayor energía que los reactivos.
dos. Un proceso endotérmico ejemplifica la vaporización del agua de la piscina por la acción de la luz solar, que solo ocurre cuando el agua de la piscina absorbe el calor del ambiente. Por otro lado, los procesos de quemar parafina de una vela, disolver ácido sulfúrico concentrado en agua líquida, quemar alcohol hidratado en motores de automóviles y formar una iceberg del agua de mar son de naturaleza exotérmica, ya que liberan calor en la transmutación de reactivos en productos.
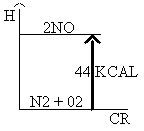
3. A 25 ° C y una atm de presión, un mol de nitrógeno, reaccionando con un mol de oxígeno gaseoso, produce monóxido de nitrógeno gaseoso con absorción de 22 kcal / mol del producto obtenido. El diagrama que representa correctamente esta información se muestra a continuación.
Así, según la posición de la flecha, se puede observar la naturaleza endotérmica del proceso. El valor de 44 Kcal se refiere a la producción de dos moles del producto, monóxido de nitrógeno (NO).
4. una sustancia LA está en sus tres estados de agregación como se muestra en el esquema siguiente (H = entalpía).
El orden descendente de entalpías será H vapor> H líquido> H sólido, ya que es en el estado de vapor donde las moléculas tendrán un mayor contenido energético (entalpía) que en los otros estados de agregación de materia.
5. La reacción entre HCl y NaOH es exotérmica, es decir, desprende calor. Se medirá una temperatura más alta inmediatamente después de la «mezcla» de 0,8 mol de HCl + 0,8 mol de NaOH que una «mezcla» de 0,6 mol de HCl + 1,0 mol de NaOH, porque en las primeras proporciones de reactivos están estequiométricamente equilibradas, y no hay exceso de reactivo ni reactivo limitante.
Referencias:
RUSSELL, John B .; Química General vol.1, São Paulo: Pearson Education of Brazil, Makron Books, 1994.