Tabla de contenidos
La función química es una agrupación de sustancias que tienen propiedades similares. Estas propiedades se denominan funcionales, ya que determinan el comportamiento de las sustancias.
Las principales funciones químicas inorgánicas son: ácidos, bases, sales y óxidos.
Ácidos
Los ácidos son compuestos formados por enlaces covalentes, donde se comparten electrones. Según el químico Svante Arrhenius (1859-1927), estos compuestos liberan iones H+ cuando están en contacto con el agua.
¿Cómo identificar un ácido?
La fórmula general de un ácido es HXA, donde A representa el anión, H es hidrógeno yx es el número de átomos de este elemento presentes en la molécula.
Hoy sabemos que en contacto con el agua, un ácido libera el H como único catión.+ y forma el ion hidronio por ionización. Además, cuando los ácidos se ionizan en una solución acuosa, son capaces de conducir electricidad.
La fuerza de un ácido se mide por su capacidad para ionizarse en contacto con el agua. Cuantas más moléculas de ácido se ionizan en el agua, más fuerte es el ácido.
Ejemplo: HCl es un ácido fuerte, ya que tiene un grado de ionización del 92%. El hdosCO3 es un ácido débil, ya que solo el 0,18% de las moléculas de ácido se ionizan en solución.
Clasificación de ácidos
Podemos clasificar los ácidos según el número de hidrógenos ionizables en:
- Monoácido: tiene solo un hidrógeno ionizable, como el HCN;
- Diácido: tiene dos hidrógenos ionizables, como HdosSOLO3;
- Triacid: tiene tres hidrógenos ionizables, como H3POLVO4;
- Tetracid: tiene cuatro hidrógenos ionizables, como H4PAGdosO7.
Los ácidos también se clasifican por la ausencia de oxígeno en hidrata, como HCl y HCN, y cuando existe el elemento oxígeno, se denominan oxiácidos, como HdosSOLO4 y HNO3.
Ejemplos de ácidos
- ácido sulfúrico, HdosSOLO4
- Ácido clorhídrico, HCl
- Ácido fluorhídrico, HF
- Ácido nítrico, HNO3
- Ácido fosfórico, H3POLVO4
- Ácido carbónico, HdosCO3
Obtenga más información sobre los ácidos.
Bases
Las bases son compuestos formados por enlaces iónicos, donde se produce la donación de electrones. Según el químico Svante Arrhenius (1859-1927) estos compuestos liberan iones OH– cuando están en contacto con el agua, ya que el compuesto se disocia.
¿Cómo identificar una base?
La fórmula general para una base es , donde B representa el catión (radical positivo) que forma la base ey es la carga que determina el número de hidroxilos (OH–).
Las bases tienen un sabor astringente, cáustico y amargo. Cuando se disocian en un medio acuoso, las bases también conducen la electricidad.
Las bases son compuestos que se disocian en solución acuosa y la fuerza de una base se mide por el grado de disociación. Por tanto, cuantas más estructuras se disocian en el agua, más fuerte es la base.
Ejemplo: NaOH es una base fuerte, ya que tiene un grado de ionización del 95%. NUEVA HAMPSHIRE4El OH es una base débil ya que solo el 1,5% del compuesto sufre disociación iónica.
Clasificación base
Las bases se pueden clasificar según el número de hidroxilos que liberan en solución en:
- Monobase: tiene un solo hidroxilo, como NaOH;
- Dibasa: tiene dos hidroxilos, como Ca (OH)dos;
- Tribase: tiene tres hidroxilos, como Al (OH)3;
- Tetrabase: tiene cuatro hidroxilos, como Pb (OH)4.
Las bases de metales alcalinos y alcalinotérreos, a excepción del berilio y el magnesio, se consideran bases fuertes debido a su alto grado de disociación. Las bases débiles, en cambio, tienen un grado de disociación inferior al 5%, como el NH4OH y Zn (OH)dos.
Ejemplos de bases
- Hidróxido de sodio, NaOH
- Hidróxido de amonio, NH4Oh
- Hidróxido de potasio, KOH
- Hidróxido de magnesio, Mg (OH)dos
- Hidróxido de hierro, Fe (OH)3
- Hidróxido de calcio, Ca (OH)dos
Obtenga más información sobre las bases.
sales
Las sales son compuestos producidos a partir de la reacción que tiene lugar entre un ácido y una base, denominada reacción de neutralización.
Por tanto, una sal está formada por un catión que procede de una base y un anión que procede del ácido.
¿Cómo identificar una sal?
Las sales son compuestos iónicos cuya estructura es CXLAy formado por un catión Cy + (ion positivo), distinto de H+y un anión AX- (ion negativo), que es diferente de OH–.
Las sales en condiciones ambientales aparecen como sólidos cristalinos, con un alto punto de fusión y ebullición. Además, muchos tienen un sabor salado característico.
Aunque algunas sales son bien conocidas y se utilizan en alimentos, como el cloruro de sodio (sal de mesa), hay sales que son extremadamente tóxicas.
Cuando están en solución acuosa, las sales son capaces de conducir electricidad. Muchas sales pueden absorber fácilmente la humedad del medio ambiente y, por lo tanto, se denominan higroscópicas.
Clasificación de sales
Las sales se clasifican según su carácter en solución acuosa.
sal neutra: formado por un catión de base fuerte y un anión de ácido fuerte o un catión de base débil y un anión de ácido débil.
Ejemplo: HCl (ácido fuerte) + NaOH (base fuerte) → NaCl (sal neutra) + HdosO (agua)
sal ácida: Formado por un catión de base débil y un anión de ácido fuerte.
Ejemplo: HNO3 (ácido fuerte) + AgOH (base débil) → AgNO3 (sal ácida) + HdosO (agua)
sal básica: formado por un catión de base fuerte y un anión de ácido débil.
Ejemplo: HdosCO3 (ácido débil) + NaOH (base fuerte) → NaHCO3 (sal básica) + HdosO (agua)
Ejemplos de sales
- Nitrato de potasio, KNO3
- Hipoclorito de sodio, NaClO
- Fluoruro de sodio, NaF
- Carbonato de sodio, NadosCO3
- Sulfato de calcio, CaSO4
- Fosfato de aluminio, AlPO4
Obtenga más información sobre las sales.
Óxidos
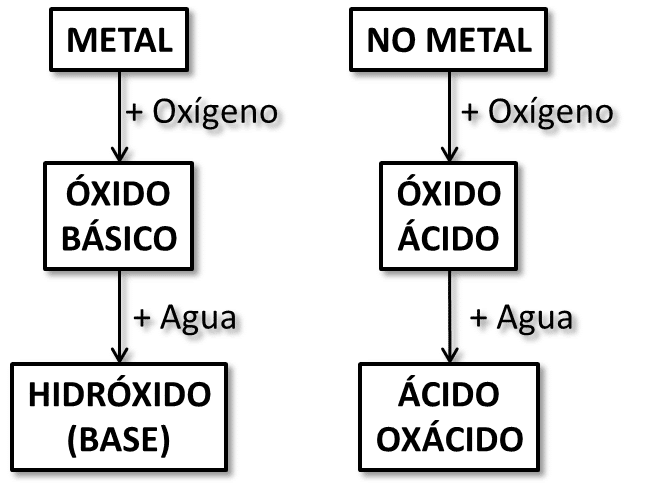
Los óxidos son compuestos formados por dos elementos químicos, uno de los cuales es el oxígeno, que es el más electronegativo del compuesto.
¿Cómo identificar un óxido?
La fórmula general de un óxido es , donde C representa el catión (ion positivo) unido al oxígeno. La y (carga catiónica) indica cuántos átomos de oxígeno deben formar el óxido.
Los óxidos son sustancias binarias, donde el oxígeno está ligado a un elemento químico que es menos electronegativo que él. Por lo tanto, la unión del oxígeno al flúor, como en los compuestos OFdos es eldosFdos, no se consideran óxidos.
Clasificación de óxidos
Los óxidos moleculares (oxígeno + metal) tienen un carácter ácido, porque cuando están en solución acuosa reaccionan produciendo ácidos, como el dióxido de carbono (COdos).
Los óxidos iónicos (oxígeno + metal) tienen un carácter básico, ya que en contacto con el agua forman soluciones básicas, como el óxido de calcio (CaO).
Cuando un óxido no reacciona con el agua, como el monóxido de carbono (CO), se caracteriza por ser un óxido neutro.
Ejemplos de óxidos
- Óxido de estaño, SnOdos
- Óxido de hierro III, FedosO3
- Óxido de sodio, NadosO
- Óxido de litio, LidosO
- Dióxido de estaño, SnOdos
- Dióxido de nitrógeno, NOdos
Obtenga más información sobre los óxidos.
¡Atención!
Las clases de ácidos, bases, sales y óxidos se organizan como funciones químicas para facilitar el estudio de los compuestos inorgánicos, ya que el número de sustancias es muy grande.
Sin embargo, en ocasiones pueden mezclarse, como en el caso de sales y óxidos, que pueden tener un carácter ácido o básico. Además, el comportamiento de las sustancias está influenciado por su interacción con otros compuestos.
En Química Orgánica, es posible visualizar los diferentes grupos funcionales de compuestos orgánicos.
Conozca también las funciones orgánicas.
Principales compuestos inorgánicos
Vea algunos ejemplos de compuestos con funciones inorgánicas y sus aplicaciones.
Ácidos
Ácido clorhídrico, HCl
El ácido clorhídrico es un monoácido fuerte. Es una solución acuosa que contiene 37% de HCl, cloruro de hidrógeno, un gas incoloro, muy tóxico y corrosivo.
Se utiliza para la limpieza de metales, en el proceso de fabricación del cuero y como materia prima para otros compuestos químicos. Esta sustancia se comercializa como ácido muriático para la limpieza de suelos, baldosas y superficies metálicas.
ácido sulfúrico, HdosSOLO4
El ácido sulfúrico es un diácido fuerte. Es un líquido incoloro y viscoso, que se considera fuerte porque su grado de ionización es superior al 50% a una temperatura de 18º C.
Este ácido inorgánico se utiliza a gran escala en la industria química, como materia prima para la fabricación de muchos materiales y, por tanto, su consumo puede indicar el índice de desarrollo económico de un país.
Bases
Hidróxido de magnesio, Mg (OH)dos
El hidróxido de magnesio es una dibasa, ya que tiene dos hidroxilos en su constitución. En condiciones ambientales, el compuesto químico es un sólido blanco y su suspensión en agua se comercializa con el nombre de Leche de Magnesia.
La leche de magnesia se utiliza como antiácido, para reducir el ácido del estómago y como laxante, mejorando las funciones intestinales.
Hidróxido de sodio, NaOH
El hidróxido de sodio, también llamado soda cáustica, se encuentra en estado sólido en condiciones ambientales, tiene un color blanquecino y es altamente tóxico y corrosivo.
Es una base fuerte, utilizada tanto en la industria, para la fabricación de productos de limpieza, como en el uso doméstico, para desatascar tuberías, por ejemplo.
El uso del producto requiere mucho cuidado, ya que el contacto con la piel puede provocar quemaduras graves.
sales
Cloruro de sodio, NaCl
La sal de mesa, cuyo nombre químico es cloruro de sodio, es una sustancia muy utilizada como condimento y conservante de alimentos.
Una de las técnicas utilizadas para producir sal de mesa es evaporar el agua de mar y cristalizar el compuesto químico. Posteriormente, la sal se somete a un proceso de refinamiento.
Otra forma en la que el cloruro de sodio está presente en nuestras vidas es en la solución salina, una solución acuosa con 0,9% de sal.
Bicarbonato de sodio, NaHCO3
El hidrogenocarbonato de sodio, conocido popularmente como bicarbonato de sodio, es una sal con cristales muy pequeños, de apariencia pulverulenta, fácilmente soluble en agua.
Es una sustancia con muchas aplicaciones domésticas, ya sea para limpieza, mezclada con otros compuestos, o para la salud, ya que está presente en la composición de efervescentes.
Óxidos
Peróxido de hidrógeno, HdosOdos
El peróxido de hidrógeno se comercializa como una solución llamada peróxido de hidrógeno, un líquido altamente oxidante. Cuando no se disuelve en agua, el peróxido de hidrógeno es bastante inestable y se descompone rápidamente.
Las principales aplicaciones de la solución de peróxido de hidrógeno son: antiséptico, blanqueador y decolorante capilar.
dióxido de carbono, COdos
El dióxido de carbono, también llamado dióxido de carbono, es un óxido molecular incoloro, inodoro y más pesado que el aire.
En la fotosíntesis el COdos La atmósfera se captura de la atmósfera y reacciona con el agua, produciendo glucosa y oxígeno. Por tanto, este proceso es importante para la renovación de oxígeno en el aire.
Sin embargo, la alta concentración de dióxido de carbono en la atmósfera es una de las causas del agravamiento del efecto invernadero, reteniendo una mayor cantidad de calor en la atmósfera.